Soluciones químicas
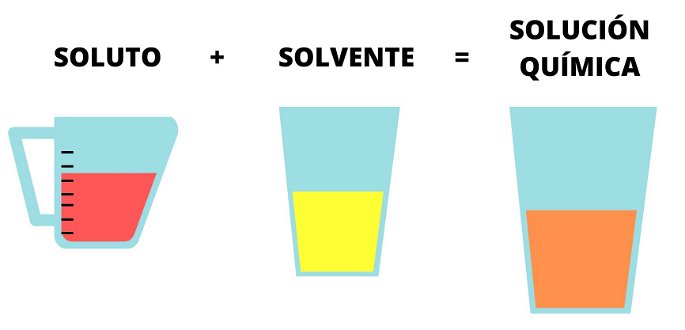
Una solución química es la mezcla homogénea de una o más sustancias disueltas en otra de mayor proporción. Está compuesta por solutos, que son las sustancias que se disuelven, y solventes, que son las sustancias que disuelven los solutos.
Las soluciones químicas, también llamadas disoluciones químicas, pueden presentar los tres estados de la materia: líquido, sólido y gaseoso. A su vez, sus solutos y solventes también pueden estar en cualquier estado, dando lugar a distintos tipos de soluciones.
Por ejemplo, la mezcla del alcohol en el agua es una solución líquida de soluto y solvente, ambos en estado líquido. Otro caso es el aire, una mezcla gaseosa y homogénea compuesta de principalmente de nitrógeno y oxígeno, además de otros gases.
Al ser mezclas homogéneas, las soluciones químicas presentan una sola fase. En otras palabras, no se puede distinguir el soluto del solvente. Además, las sustancias polares solo disuelven otras sustancias polares, mientras que las apolares disuelven a otras apolares.
Para conocer qué sustancias componen la solución química, es necesario emplear técnicas de separación como la evaporación o destilación.
Tipos de soluciones químicas
Existen diferentes tipos de soluciones químicas según tres diferentes criterios. Por un lado, existen soluciones químicas según el grado de solubilidad del soluto. Por el otro, las soluciones se pueden clasificar acorde al estado de agregación de la materia. Por último, las soluciones químicas se describen según el tipo de solvente utilizado.
Soluciones químicas según el grado de solubilidad
Según el grado de solubilidad del soluto en el solvente, tenemos:
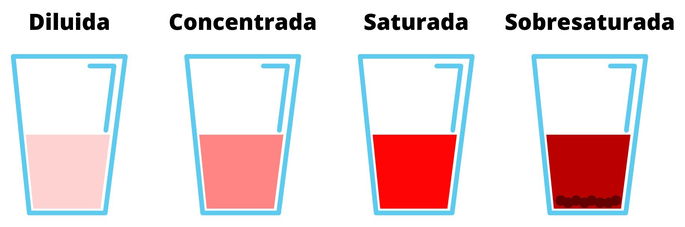
- Soluciones insaturadas, que son aquellas en las que se puede agregar más soluto. A su vez, estas se clasifican en soluciones diluidas, que presentan un porcentaje bajo de soluto respecto al solvente, y soluciones concentradas, que tienen un gran porcentaje de soluto en el solvente.
- Soluciones saturadas, que son aquellas que no admiten más soluto en el solvente. A partir de este límite, la solución será heterogénea y presentará por lo menos dos fases.
- Soluciones sobresaturadas, que son las que poseen más soluto de lo que admite el solvente y, por lo tanto, se puede apreciar una mezcla heterogénea. Para que el soluto se disuelva, es necesario añadir más solvente y/o aumentar la temperatura.
Ver también: Soluto y solvente y Concentración química
Soluciones químicas según el estado de agregación de la materia
A pesar de que las soluciones químicas se suelen encontrar generalmente en estado líquido, también pueden estar en estado gaseoso o sólido.
Según el estado resultante, las soluciones químicas pueden ser:
- Soluciones sólidas, en el que el estado resultante de la solución química es una mezcla sólida.
- Soluciones líquidas, en el que el estado resultante de la solución química es una mezcla líquida.
- Soluciones gaseosas, en el que el estado resultante de la solución química es una mezcla gaseosa.
En todos los tipos de soluciones químicas, el soluto puede ser de cualquier estado de agregación de la materia. De aquí surgen otros subtipos, como las soluciones de solvente líquido y soluto gaseoso, o de solvente líquido y soluto sólido.
Soluciones químicas según el tipo de solvente utilizado
Por último, las soluciones químicas se pueden clasificar según el tipo de solvente que se utilice.
- Soluciones acuosas, en las que el solvente utilizado es el agua. Son el tipo más abundante de soluciones químicas.
- Soluciones alcohólicas, las cuales emplean alcoholes como solvente. Los más populares son el etanol y metanol.
- Soluciones salinas, que poseen sal y agua destilada como solvente de otros componentes. La mezcla de sal en agua destilada se utiliza para fines médicos, pero también sirve como solvente de glucosa y algunos polisacáridos.
- Aleaciones de metal, que son mezclas homogéneas de dos metales en estado sólido. Algunos ejemplos son el acero (hierro y carbono), el latón (cobre y zinc) o el oro blanco (oro mezclado con níquel, plata o paladio, entre otros).
Características de las soluciones químicas
La solución siempre resulta de la mezcla entre el soluto, que es la sustancia que se disuelve, y el solvente, que es la sustancia en que disuelve un soluto. En algunos casos puede haber más de un soluto, en cuyo caso seguirá siendo una solución química siempre y cuando los solutos no reaccionen entre sí.
La solución química se caracteriza por la mezcla de componentes que no reaccionan químicamente entre sí. Si lo hicieran, se formarían nuevos compuestos.
Existen diferentes tipos de soluciones dependiendo de la cantidad de soluto disuelto. Sin embargo, la solubilidad también cambia en función de la temperatura y presión. Por ejemplo, a mayor temperatura, más alta será la solubilidad del soluto en un solvente.
Generalmente, las características físicas de una solución química son más parecidas a las del solvente, ya que su concentración es mayor. Conforme aumenta la proporción de solutos, propiedades como la densidad, punto de ebullición, textura o fluidez se ven modificadas.
Ejemplos de soluciones químicas
Pongamos como ejemplo un paquete de jugo en polvo como soluto y agua como solvente. Si echamos un poco de jugo, la concentración será tan baja que quedará diluido. En cambio, si ponemos todo el jugo en el agua, la mezcla cambiará bastante de color, mostrando una solución concentrada.
¿Y si echamos dos paquetes de jugo en polvo? La solución no solamente se saturará, sino que puede sobresaturarse. En este caso, veríamos parte del polvo al fondo del recipiente. De esta forma, podemos ver cómo la solución química cambia sus características según la cantidad de soluto en el solvente.
Otros ejemplos de soluciones químicas son:
- El hidrógeno, en su estado gaseoso, puede disolverse en paladio, en su estado sólido. Esto resulta en una solución química sólida.
- La sal de mesa, en su estado sólido, se disuelve muy bien en agua líquida. El resultado es una solución química líquida.
- El vapor de agua se disuelve en el aire, lo que da lugar a una solución química gaseosa.
- El mercurio, en su estado líquido, se puede mezclar con algunos metales sólidos como la plata, el oro o el estaño. Dependiendo de la proporción de mercurio, la solución química será sólida (mercurio como soluto) o líquida (mercurio como solvente).
- El agua de mar es una solución química compuesta de oxígeno, sales y otros gases como solutos, y el agua como solvente.
- Una bebida carbonatada como los refrescos suele contener dióxido de carbono en estado gaseoso y azúcar en estado sólido, ambos disueltos en un agua que puede contener aditivos, saborizantes y otros elementos.
Concentración de soluciones químicas
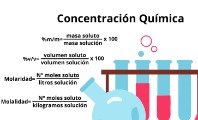
La concentración química determinará, en unidades físicas de peso, volumen o partes por millón (ppm), el porcentaje de soluto presente en la solución.
La concentración de soluto en las soluciones se suele expresar en:
- Molaridad: determina la concentración de soluto en moles, dividido en el volumen del solvente. Se suelen utilizar los moles y litros como unidades, es decir, mol (soluto) / l (solvente).
- Molalidad: determina la concentración de soluto en moles, dividido en el peso del solvente. Usualmente, las unidades son moles y kilogramos, es decir, mol (soluto) / kg (solvente).
- Fracción molar: determina la concentración de soluto en moles, dividido en moles de solvente, es decir, mol (soluto) / mol (solvente).
El conocimiento de la concentración en una solución química es importante. Ello determinará la cantidad de soluto y solvente presentes para determinar los factores de cambio y así recrear la solución para su uso o estudio posterior.
Ver también:
Cómo citar: Rhoton, Stephen (26/03/2025). "Soluciones químicas". En: Significados.com. Disponible en: https://www.significados.com/solucion-quimica/ Consultado: