Reacciones redox
Las reacciones redox, de oxidación-reducción u óxido-reducción son aquellas en que al menos una sustancia se oxida y otra se reduce. En concreto, lo que sucede es que la sustancia que se oxida cede electrones, mientras que la que se reduce gana electrones. Por ello, en estas reacciones siempre se produce una transferencia de electrones entre átomos.
A raíz de esta transferencia de electrones, hay un cambio en el estado de oxidación de las sustancias. Dependiendo de si disminuye o aumenta, la sustancia se llamará de una y otra forma:
- Agente oxidante: es la sustancia que acepta o atrae electrones en una reacción redox, por lo que reduce su estado de oxidación. Suelen ser elementos muy electronegativos, como el oxígeno (O), iodo (I), bromo (Br), o compuestos como el permanganato de potasio (KMnO4), el cloruro de potasio (KClO3) o el dicromato de potasio (K2Cr2O7).
- Agente reductor: es la sustancia que cede o dona electrones en una reacción redox, aumentando así su estado de oxidación. Suelen ser elementos menos electronegativos, como el hierro(II) (Fe2+), el hierro(III) (Fe3+), el sodio (Na) o magnesio (Mg).
Cada reacción redox se puede dividir en dos semirreacciones o reacciones parciales: la de oxidación, y luego la de reducción. Para ilustrar esto, veamos la formación del óxido cúprico u óxido de cobre(II).
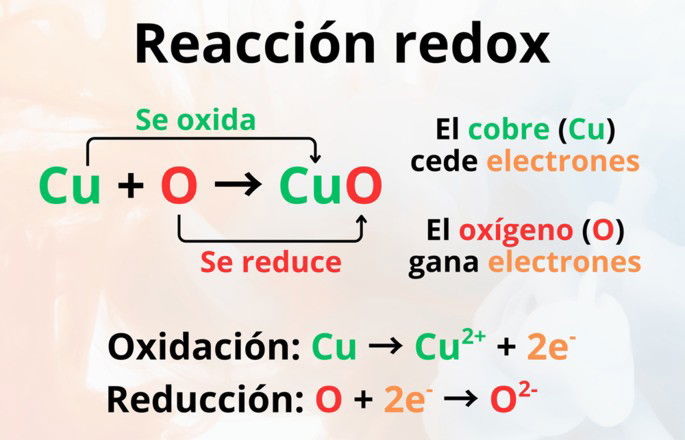
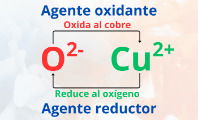
La reacción del cobre con el oxígeno para formar el óxido cúprico es la siguiente:
Si desglosamos esta reacción redox en sus dos semirreaciones, veremos qué sucede durante la oxidación y reducción:
El cobre cede dos electrones, oxidándose a Cu2+ y reduciendo el oxígeno; por ello, el cobre es el agente reductor, ya que aumentó su estado de oxidación. En cambio, el oxígeno acepta los dos electrones, reduciéndose a O2- y oxidando al cobre; por tanto, el oxígeno es el agente oxidante, pues disminuyó su estado de oxidación.
Las reacciones redox suceden porque los átomos, al combinarse, buscan una configuración electrónica similar a la de los gases nobles. Para ello, precisan ganar o ceder electrones, dependiendo de cuán electronegativos sean los átomos.
Estas reacciones suceden en diferentes ámbitos de la vida cotidiana. El ejemplo más conocido es la oxidación del hierro a lo largo del tiempo. También se da en procesos metabólicos, combustiones o en celdas electroquímicas, en las que hay un ánodo (donde sucede la oxidación) y un cátodo (donde sucede la reducción).
Ejemplos de reacciones redox
Veamos unos cuantos ejemplos más de reacciones redox junto con sus semirreaciones de oxidación y reducción.
Reacción del sulfato de cobre(II) con zinc
El sulfato de cobre(II) (CuSO4), en una solución que contenga zinc (Zn), reacciona con dicho elemento de la siguiente forma (Zn):
Durante la reacción, el zinc cede dos electrones y se oxida, por lo que actúa como agente reductor. En cambio, el cobre acepta los dos electrones y se reduce, actuando como agente oxidante.
Lo que ha sucedido aquí es que el zinc reemplazó el cobre para enlazarse con el sulfato (SO42-), una sal o éster que proviene del ácido sulfúrico. Para que se dé este cambio, el cobre necesita que el zinc le ceda dos electrones; por eso sucede la reacción redox.
Reacción de formación del cloruro de sodio
El sodio (Na) y el dicloro (Cl2) pueden reaccionar para formar dos moléculas de cloruro de sodio (NaCl). La reacción redox y sus semirreaciones son:
Durante la formación del cloruro de sodio, el sodio cede un electrón, aumentando su estado de oxidación a +1. Acto seguido, el cloro acepta dicho electrón, disminuyendo su estado de oxidación a -1. Esto permite que el sodio y el cloro se unan para formar la sal que conocemos como sal de mesa.
Reacción de la oxidación del hierro(III)
El hierro(III) es el hierro que se oxida a +3, a diferencia del hierro(II), que se oxida a +2. A raíz del mayor número de oxidación, se precisan más átomos de hierro y oxígeno para que se forme la molécula:
El hierro libera 3 electrones y se oxida a Fe3+, mientras que el oxígeno toma 2 electrones y se reduce a O2-. Como hay una disparidad en la cantidad de electrones que se transfieren, es necesario que se combinen dos átomos de hierro y tres átomos de oxígeno para formarse el óxido de hierro(III).
Tipos de reacciones redox
Las reacciones redox se clasifican según la velocidad de reacción y los reactivos que se oxidan o reducen. Los tipos a destacar son las oxidaciones de metales y combustiones, así como de doble desplazamiento o de desproporción.
Oxidaciones de metales
Las oxidaciones de metales son uno de los procesos de oxidación-reducción más lentos. En general sucede cuando metales como el hierro, cobre, aluminio o zinc están en presencia de agua y oxígeno, aunque puede darse con otros reactivos.
Cuando la reacción redox da lugar, es el metal el que se oxida, es decir, cede electrones. El material que se reduce, usualmente el oxígeno, es el aceptor de electrones. Dos ejemplos de estas reacciones son las que mostramos de la formación del óxido de cobre(II) (CuO) y el óxido de hierro(III) (Fe2O3).
Combustiones
Las combustiones son un tipo de reacciones redox que liberan grandes cantidades de energía en forma de calor y luz. Son muchísimo más rápidas, por lo que pueden resultar peligrosas cuando hay una cantidad considerable de reactivos.
Un ejemplo de combustión es la quema de combustibles en presencia de oxígeno.
Reacciones de desplazamiento doble
El último tipo de reacciones redox son las de desplazamiento doble. Lo que sucede en estas reacciones es que un átomo intercambia de lugar con otro átomo que forma parte de una molécula. Al reaccionar, el primer átomo se oxida para unirse a la molécula, mientras que el átomo que formaba parte de la molécula se reduce y se separa de ella.
Un ejemplo es el caso que mostramos en este artículo del zinc (Zn) reaccionando con sulfato de cobre (CuSO4), en el que el zinc y el cobre se intercambian.
Reacciones de desproporción
Las reacciones de desproporción, anfolización o dismutación son aquellas en las que un mismo elemento o sustancia se oxida y se reduce al mismo tiempo. Esto pasa cuando un elemento puede presentar tres estados de oxidación o más.
Algunos ejemplos de elementos que participan en reacciones de desproporción son el nitrógeno, el azufre, el fósforo y el manganeso.
Vea también:
Cómo citar: Rhoton, Stephen (18/04/2025). "Reacciones redox". En: Significados.com. Disponible en: https://www.significados.com/reacciones-redox/ Consultado: