Reacción química
Una reacción química, o cambio químico, es la transformación que sufre una sustancia al reaccionar con otra o al hallarse en condiciones favorables para el cambio.
En una reacción química se rompen algunos enlaces químicos entre moléculas y átomos para formar enlaces nuevos. Es decir, la materia ve alterada tanto su estructura como composición molecular, cambiando su naturaleza.

La reacción química es un proceso que puede suceder de forma espontánea o mediante nuestra intervención. Un ejemplo de reacción espontánea es la fotosíntesis de las plantas y algunas bacterias, que podemos representar con la siguiente ecuación:
Es decir, que a partir de dióxido de carbono (CO2), agua (H2O) y la energía procedente de la luz solar, los átomos se recombinan para formar moléculas de glucosa (C6H12O6) y oxígeno (O2). Aquí se puede apreciar que el hidrógeno se separó del oxígeno en el agua para juntarse con el dióxido de carbono, formando glucosa.
Un ejemplo de reacción ocasionada mediante nuestra intervención es al mezclar, en un laboratorio, ácido clorhídrico (HCl) e hidróxido de sodio (NaOH):
En este caso, vemos que el cloro y el sodio rompen sus enlaces con el hidrógeno y oxígeno para unirse, formando así la sal común (NaCl).
Las ecuaciones químicas, como las que hemos mostrado en los ejemplos, nos permiten entender cómo cambian las sustancias al reaccionar. Eso sí, aparte de la formación de nuevas sustancias, en una reacción química pueden suceder otros fenómenos como la generación de calor, luz o corriente eléctrica.
Las reacciones químicas se ven influenciadas por factores como:
- La cantidad o concentración de reactivos y/o productos en el medio;
- El estado de agregación de los reactivos, es decir, si son sólidos, líquidos o gas;
- La temperatura;
- La presión;
- La presencia de catalizadores o inhibidores;
- La presencia de energía luminosa o de corrientes eléctricas.
Partes de una reacción química
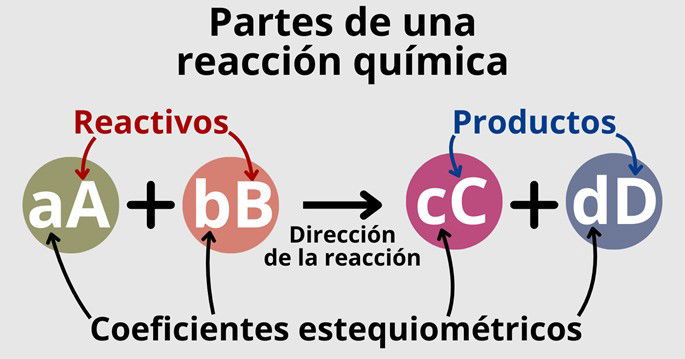
En general, una reacción química presenta la siguiente estructura:
En que:
- A y B son los reactivos o reactantes, es decir, aquellas sustancias que reaccionan entre sí;
- C y D son los productos, es decir, las sustancias nuevas que se forman a raíz de la interacción entre los reactivos.
En una reacción, puede haber diferentes cantidades de reactivos y productos; no tienen por qué ser iguales. Lo que sí debe ser igual es la cantidad de átomos de un elemento, tanto en el lado de los reactivos como de los productos. Para ello, nos servimos de los coeficientes estequiométricos (a, b, c y d), que indican la cantidad de reactivos/productos necesaria para llevar a cabo la reacción.
Para entender la importancia de los coeficientes estequiométricos, retomemos el ejemplo de la fotosíntesis:
Vemos que el dióxido de carbono (CO2), agua (H2O) y oxígeno (O2) poseen un mismo coeficiente estequiométrico: el número 6. Gracias a este coeficiente, hay el mismo número de carbonos (6), oxígenos (18) e hidrógenos (12) en cada lado de la reacción. De esta forma, sabemos cómo se recombinan todos los átomos implicados en las sustancias.
Otros elementos claves en una reacción química son:
- Calor: una reacción química siempre absorbe o genera calor.
- Luz: algunas reacciones químicas precisan de la energía solar para funcionar, mientras que otras pueden emanar luz.
- Corrientes eléctricas: hay reacciones que suceden solo cuando hay una corriente eléctrica; en otros casos, la reacción puede producir una corriente.
- Catalizadores: son sustancias que no intervienen directamente en la reacción, pero sí la aceleran.
- Inhibidores: tampoco intervienen en la reacción química, pero su presencia la ralentiza.
Vea también Fotosíntesis y Química.
Tipos de reacciones químicas
Existen en el campo de la química inorgánica cuatro tipos de reacciones químicas: de síntesis, de descomposición, de sustitución simple o doble sustitución.
Reacciones de síntesis o adición
Son aquellas en que los reactivos se juntan formando un producto, y siguen la siguiente estructura: A + B → AB. Un ejemplo de reacción de síntesis es al combinar etileno (C2H4) con agua (H2O) para formar etanol (C2H6O).
Reacciones de descomposición o análisis
Se refieren a aquellas en que de un reactivo se forman varios productos, y siguen la siguiente estructura: AB → A + B. Un ejemplo de reacción de descomposición es al calentar el hidróxido de sodio (NaOH), que produce óxido de sodio (Na2O) y agua (H2O).
Reacciones de desplazamiento o sustitución simple
Se tratan de reacciones en el que el elemento de un reactivo rompe el enlace químico y se combina con otro reactivo, creando un producto distinto. Siguen la siguiente estructura: AB + C → A + BC. Por ejemplo, el zinc (Zn) reacciona con ácido clorhídrico (HCl), produciendo cloruro de zinc (ZnCl2) e hidrógeno (H2).
Reacciones de doble sustitución
Son reacciones en que los elementos de los reactivos se intercambian de lugar, formando varios productos nuevos. Siguen la siguiente estructura: AB + CD → AD + CB. Un caso es la reacción entre el sulfuro de sodio (Na2S) y el ácido clorhídrico (HCl), que forman cloruro de sodio (NaCl) y sulfuro de hidrógeno (H2S).
Las reacciones químicas también se pueden dividir según la reversibilidad de las mismas:
- Reacciones reversibles: son aquellas reacciones en el que los productos pueden reaccionar para volver a formar los mismos reactivos, es decir, la reacción sucede en ambas direcciones.
- Reacciones irreversibles: son las reacciones químicas que solo suceden en una sola dirección, o sea, se forman productos, pero estos no reaccionan para formar los reactivos.
Además, podemos clasificar las reacciones según la naturaleza de los reactivos:
- Reacciones orgánicas: son aquellas reacciones químicas en las que los reactivos son sustancias orgánicas.
- Reacciones inorgánicas: son aquellas cuyos reactivos son sustancias inorgánicas.
- Ácido-base o neutralización: en estas reacciones, un ácido reacciona con una base, intercambiando protones (H+) y neutralizando los compuestos. En algunos casos, se producen sales y agua, pero no siempre es así.
- Oxidación-reducción o redox: en este tipo de reacciones químicas se transfieren electrones entre las sustancias.
- Combustión: es una reacción de oxidación rápida que genera bastante calor.
Otra forma de clasificar las reacciones químicas es por la absorción o generación de calor, luz o corriente eléctrica:
- Endotérmicas: las sustancias necesitan absorber calor para que ocurra la reacción química.
- Exotérmicas: las sustancias desprenden calor al reaccionar químicamente.
- Endoluminosas: los reactivos precisan de luz para reaccionar.
- Exoluminosas: se emana luz como resultado de estas reacciones químicas.
- Endoeléctricas: las sustancias solo reaccionan cuando se les aplica una corriente eléctrica.
- Exoeléctricas: a raíz de la reacción química, se genera una corriente eléctrica.
Vea también Reacción exotérmica y Propiedad química.
Cómo citar: Rhoton, Stephen (22/01/2025). "Reacción química". En: Significados.com. Disponible en: https://www.significados.com/reaccion-quimica/ Consultado: