Reacción exotérmica
Una reacción exotérmica o proceso exotérmico es una reacción química que libera energía en forma de calor o luz. Es decir, al reaccionar los reactivos, se forman productos y se genera energía que se puede aprovechar para otras reacciones o procesos biológicos.
Esto sucede porque la energía que contienen las moléculas de los reactantes es mayor que la energía que contienen las moléculas de los productos. Entonces, parte de esta energía química es liberada de otra forma, es decir, en calor o luz.

Un ejemplo bastante común es la combustión del carbono, en la cual moléculas de carbono reaccionan con oxígeno para formar dióxido de carbono:
Ahora, ¿cómo comunicamos que esta reacción es exotérmica? Mediante la magnitud de la entalpía de formación, de símbolo ΔH. Esta magnitud nos indica cuánta energía absorbe o genera una reacción, y se mide en kilo Joules por mol (kJ/mol) o kilo calorías por mol (kcal/mol).
En este caso, una reacción exotérmica posee una entalpía de formación menor de cero, es decir, ΔH < 0. Por ejemplo, en la reacción del carbono con el oxígeno se liberan aproximadamente 394 kJ/mol. Lo podemos representar de las siguientes formas:
Cabe mencionar que las reacciones exotérmicas pueden ser peligrosas por lo rápida que pueden suceder. En algunos casos, se genera tanta energía como para producir humo, llama o incluso explosiones.
Más ejemplos de reacciones exotérmicas
La combustión del metano (CH4) resulta en lo siguiente:
Es decir, que de la reacción entre el metano y el oxígeno (O2), no solo se liberan dióxido de carbono (CO2) y agua (H2O), sino 890 kilo Joules de energía.
Otro caso más es el amonio (NH3) reaccionando con el ácido clorhídrico (HCl) para formar cloruro de amonio (NH4Cl):
Finalmente, también está el caso de la plata (Ag) que reacciona con el cloro (Cl), formando cloruro de plata (AgCl):
Hay muchos casos más en que la reacción es exotérmica. El permanganato de potasio, un sólido que contiene oxígeno, y la glicerina, un líquido orgánico combustible, son dos sustancias que al reaccionar producen luz y calor.
Otro ejemplo es el resultado de la mezcla de agua oxigenada y el yoduro de potasio, De esta combinación se genera un burbujeo, calor y finalmente humo, que es la energía que se libera de esta reacción exotérmica.
A continuación, compartimos más ejemplos de reacciones exotérmicas:
- Reacciones de combustión y oxidación: cuando los compuestos orgánicos como el carbón y la madera reaccionan con el oxígeno para formar dióxido de carbono, se produce luz y calor. La oxidación, una reacción en la que también interviene el oxígeno, es generalmente exotérmica, como el caso de la oxidación del hierro.
- Reacción del detergente: el detergente en polvo con agua produce calor.
- Formación de amoniaco: surge de la reacción del nitrógeno con el hidrógeno.
- Oxidación de la glucosa en las células: ocurre para generar dióxido de carbono y energía en forma de ATP.
- Bicarbonato de sodio y el vinagre: se libera dióxido de carbono y calor.
Diferencia entre reacción exotérmica y endotérmica
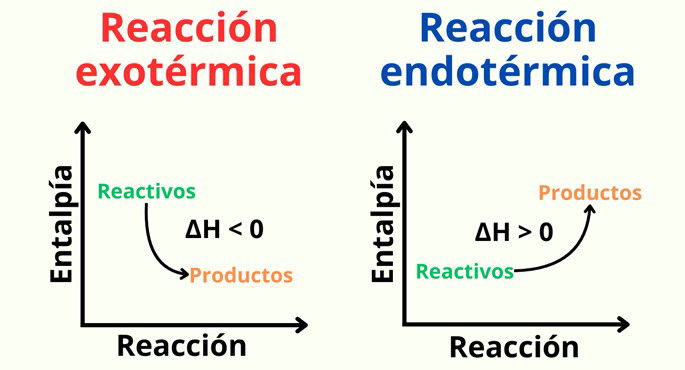
Una reacción exotérmica es aquella en la que se libera energía como uno de los productos. La reacción endotérmica, en cambio, es aquella que absorbe energía.
En otras palabras, en la reacción exotérmica, la energía de los reactivos es mayor que la de los productos, ya que se ha liberado energía en el proceso. En una reacción endotérmica, la energía de los reactivos es menor que la de los productos, pues se absorbió energía para llevar a cabo la reacción.
Podemos verificar si una reacción es exotérmica o endotérmica según el valor de la entalpía (ΔH). Esta magnitud representa el flujo de energía térmica en una reacción. Para el caso que nos ocupa, una reacción exotérmica presenta una entalpía negativa (ΔH<0), mientras que una reacción endotérmica será positiva (ΔH>0).
Vea también Reacción endotérmica y Reacción química.
Cómo citar: Rhoton, Stephen (23/01/2025). "Reacción exotérmica". En: Significados.com. Disponible en: https://www.significados.com/reaccion-exotermica/ Consultado: