Reacción endotérmica
Una reacción endotérmica o proceso endotérmico es un tipo de reacción química en la que se consume energía en forma de calor. Esto es debido a que, en este tipo de reacción, los productos formados contienen más energía que los reactivos iniciales.
Para entender cómo funciona una reacción endotérmica, es necesario entender el concepto de entalpía. La entalpía, o entalpía de formación, es la cantidad de energía que un sistema determinado puede absorber o liberar al ambiente. Entonces, en una reacción endotérmica, la variación de entalpía es mayor a cero (ΔH>0), ya que el sistema gana energía.
Como los productos resultantes son más energéticos que los reactivos iniciales, se requiere una absorción de energía del entorno para cubrir esa necesidad. Este proceso genera una ruptura de los enlaces activos, y es cuando se produce la reacción endotérmica.
La energía absorbida en forma de calor tiene que ser tomada de algún lugar. En este caso, puede provenir de otras reacciones, procesos biológicos, o del medio. De hecho, en muchas reacciones endotérmicas, el proceso implica un descenso de la temperatura en el ambiente.

Un ejemplo de reacción endotérmica es el paso del hielo al agua líquida cuando comienza a derretirse:
Es decir, para que un mol de hielo se derrita, se precisa aproximadamente 6 kilo Joules de energía. Esto no pasa solamente con el agua, sino en toda sustancia que pasa de sólido a líquido, y de líquido a gas. La razón es que un líquido contiene más energía que un sólido, por ejemplo, por lo que es necesario absorber energía para realizar esta transformación en el estado de la materia.
Ejemplos de reacciones endotérmicas
Los ejemplos más comunes de reacciones endotérmicas se encuentran en la cocina. Para hacer un pan se requiere de una fuente de calor, que será absorbida por la masa para que ocurran las reacciones químicas necesarias que darán como producto final un pan horneado.
Otros ejemplos de reacciones endotérmicas serían:
- La fotosíntesis de las plantas: a partir de la energía obtenida por la luz solar, las plantas pueden producir glucosa y oxígeno a partir de agua y dióxido de carbono.
- La producción de ozono: las moléculas de oxígeno absorben energía de la radiación ultravioleta para convertirse en ozono (O3).
- Obtención de sulfuro de hierro: para obtener este componente es necesario combinar el hierro con ácido sulfhídrico, por lo que es necesario aplicar calor para estimular la reacción endotérmica.
- Hidrólisis: es el proceso en el que las moléculas de hidrógeno y oxígeno que componen el agua, se separan por la acción de la energía eléctrica.
Veamos un par de casos de reacciones endotérmicas y la cantidad de energía que absorben, junto con las ecuaciones químicas.
El primer caso es la descomposición del carbonato de calcio (CaCO3) en dos productos: el óxido de calcio (CaO) y el dióxido de carbono (CO2). Entonces, la ecuación es:
Es decir, para llevar a cabo la descomposición, el carbonato de calcio absorbe primero 177,8 kJ de energía. Otro caso es la formación del cloruro de bromo (BrCl) a partir de moléculas de bromo (Br) y cloro (Cl):
Por tanto, las moléculas de bromo y cloro han de absorber primero 29,4 kJ de energía para reaccionar y combinarse en cloruro de bromo.
Diferencia entre reacción endotérmica y exotérmica
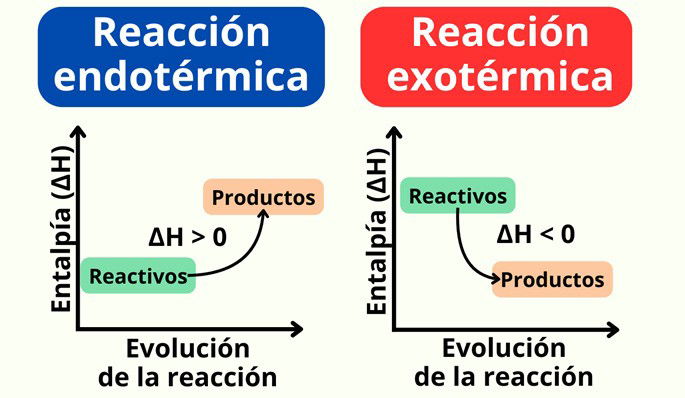
En las reacciones endotérmicas, los reactivos absorben energía para formar una serie de productos. Por lo tanto, los productos terminan con mayor energía que los reactivos.
En las reacciones exotérmicas es al revés, es decir, los productos terminan con menos energía que los reactivos, ya que parte de la energía se ha liberado en forma de calor.
Si comparamos la entalpía en ambos casos, en una reacción endotérmica, la entalpía es mayor que cero: ΔH > 0. En cambio, en la reacción exotérmica, la entalpía es menor de cero, ΔH < 0. Como se genera energía, eso significa que el sistema la pierde.
También te puede interesar Reacción exotérmica y Reacción química.
Cómo citar: Rhoton, Stephen (24/01/2025). "Reacción endotérmica". En: Significados.com. Disponible en: https://www.significados.com/reaccion-endotermica/ Consultado:





