Sublimación
La sublimación en química y física sucede cuando una sustancia pasa directamente del estado sólido al gaseoso, sin entrar en la fase líquida. La deposición o sublimación inversa es el proceso inverso: la sustancia pasa del estado gaseoso al sólido.
La sublimación se da cuando se cumplen ciertas condiciones de presión y temperatura. En general, cada sustancia puede hallarse en estado sólido, líquido o gaseoso al modificar ambos parámetros. No obstante, toda sustancia tienen un punto triple, debajo del cual solo pueden hallarse en estado sólido o gaseoso.
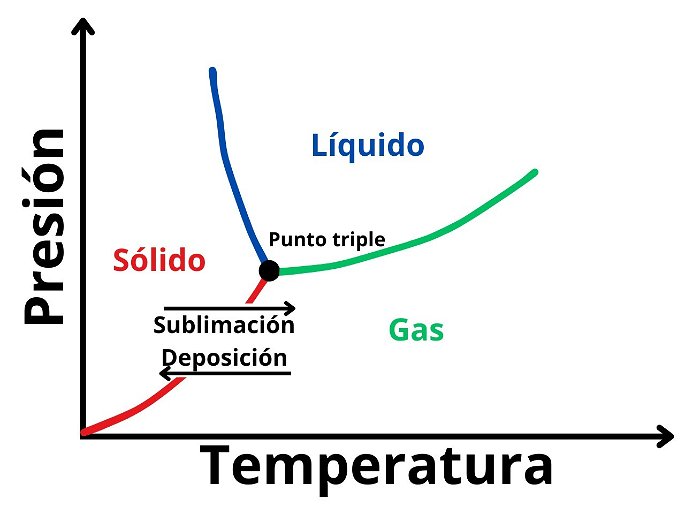
Un diagrama de fases con la sublimación y deposición enmarcada, inferior al punto triple.
Si una sustancia se halla una presión muy baja y aumentamos la temperatura, las partículas romperán los enlaces entre sí. Esto hace que el cuerpo sólido sublime y se convierta en una sustancia gaseosa. Si luego volvemos a aumentar la presión, sin superar el punto triple, la sustancia se someterá a una sublimación inversa, volviendo al estado sólido.
Cada elemento o compuesto sublima a diferentes temperaturas y presiones. Gracias a esto, la sublimación sirve para purificar o destilar mezclas sólidas. A partir de este proceso, uno puede obtener una sustancia en su forma sólida o gaseosa, aprovechando los diferentes puntos triples y curvas de sublimación.
Ejemplos de la sublimación

La naftalina, utilizada para repeler polillas, es un sólido blanquecino que sublima con facilidad a temperatura ambiente.
El hielo seco, que es el dióxido de carbono (CO2) congelado a temperaturas muy bajas, sublima al ponerlo en contacto con el aire. Esto es debido a que el dióxido de carbono sublima fácilmente excepto a una presión cinco veces más alta de la atmosférica.
El iodo, a temperatura ambiente y presiones muy por debajo de la atmosférica, puede llegar a sublimar. Cuando se somete a este proceso, desprende un gas de color violeta.
La técnica de impresión con tinta o sublimación textil es un caso cotidiano conocido. Por ejemplo, al poner tinta líquida sobre el papel, la tinta se solidifica. Si ponemos el papel sobre una tela u otro material y aplicamos calor, la tinta sublima y se une químicamente con el material frío, pasando otra vez a estado sólido.
La formación de nieve o escarcha es un ejemplo de sublimación inversa. El vapor de agua, al enfriarse mucho, puede pasar a estado sólido sin convertirse en un líquido.
La liofilización es un proceso en el que se congela un producto o alimento, para luego bajar la presión al vacío. Cuando la presión es suficientemente baja, el hielo contenido en el producto o alimento sublima. Esto sirve para conservarlo durante un periodo extendido de tiempo o facilitar el transporte, ya que pesará menos.
Algunos metales como el zinc o cadmio subliman con mayor facilidad a presiones bajas, comparado con otros elementos.
Características de la sublimación
- La sublimación es un proceso endotérmico, mientras que la deposición o sublimación inversa es un proceso exotérmico.
- Toda sustancia posee un punto triple en su diagrama de fases, por lo que puede sublimarse o deponerse en las condiciones adecuadas.
- Por encima del punto triple, la sustancia siempre pasará por el estado líquido antes de convertirse en un sólido o gas, por lo que no hay sublimación o deposición.
- La sublimación sucede cuando las condiciones del ambiente facilita la dispersión de los átomos o moléculas, de forma que rompen los enlaces químicos, pasando al estado gaseoso.
- La temperatura y/o presión a la que subliman o deponen las sustancias varía de una a otra.
- La sublimación es también una técnica para purificar mezclas sólidas, pues una sustancia pasa al estado gaseoso, mientras que la otra permanece en su estado sólido.
Vea también:
Cómo citar: Rhoton, Stephen (15/09/2023). "Sublimación". En: Significados.com. Disponible en: https://www.significados.com/que-es-sublimacion/ Consultado: