Plata (Ag)
La plata, de símbolo Ag, es un elemento químico perteneciente al grupo de los metales de transición. Se caracteriza por su tonalidad blanca o grisácea brillante, su resistencia a la oxidación, y la facilidad en trabajar con ella.
Este metal posee un valor económico alto y forma parte de los metales preciosos. De hecho, la plata ha sido utilizada como moneda y reserva de valor, así como para la joyería y la elaboración de utensilios, entre otras aplicaciones.

La plata es uno de los elementos más conductivos que existe. Por un lado, es el elemento con mayor conductividad térmica, y por el otro, se trata del metal con la conductividad eléctrica más alta. Además, este metal refleja el 95% de la luz incidente, siendo así el elemento más reflectante.
Aproximadamente tres cuartas partes de la plata producida son un subproducto de la extracción de otros minerales, sobre todo de cobre y de plomo. También se suele encontrar combinada con cloro, arsénico y azufre, y en minerales como argentita, pirargirita o polibasita, entre otros.
Actualmente, los mayores productores de plata son México, China, Perú, Chile y Australia. No obstante, Europa era el centro de producción más importante durante milenios, especialmente en la Edad Media, usando la plata en la fabricación de monedas, joyería y orfebrería.
El símbolo de la plata, Ag, proviene del latín argentum, cuyo significado es “brillante”. La palabra plata, en cambio, proviene del latín platus y hace referencia a una lámina metálica.
Características de la plata
La plata tiene ciertas características que la diferencian de otros elementos:
- Es un metal con una conductividad eléctrica y térmica muy alta, por lo que es útil en aplicaciones eléctricas. Sin embargo, su alto precio impide que sea viable a gran escala.
- La plata se encuentra en su estado sólido a temperatura ambiente, gracias a punto de fusión alto.
- Los dos isótopos más estables de la plata son el 107Ag y 109Ag.
- Es un metal escaso en su forma pura, aunque más abundante que el oro.
- La plata es un metal altamente maleable y dúctil, lo cual significa que puede deformarse y trabajarse sin romperse. No obstante, es menos blanda que el oro.
- Se encuentra en la naturaleza mezclada con otros metales y minerales, y en una menor proporción, como elemento libre.
- La plata refleja el 95% de la luz que incide sobre ella, lo que la convierte en el metal con mayor índice de reflexión.
- Tiene buena resistencia a la oxidación.
- No reacciona con la mayoría de ácidos orgánicos y soluciones alcalinas.
- La plata se empaña en presencia de aire con azufre, ozono o sulfuro de hidrógeno, y reacciona con ácidos oxidantes como el ácido nítrico o sulfúrico concentrado.
- Es muy miscible con la mayoría de elementos de los primeros tres grupos, excepto el hidrógeno, litio y berilio.
- Puede alearse fácilmente con casi todos los metales, excepto el hierro y el cobalto.
Aplicaciones de la plata

La plata en su forma pura ha servido para varios fines. Algunos ejemplos son:
- Fabricación de monedas.
- Creación de joyas u objetos utilitarios, como cubiertos, bandejas o asas de tazas.
- Elaboración de las medallas de plata, usadas para premiar al segundo lugar en competiciones.
- Producción de circuitos integrados para computadoras.
- Creación de las placas solares.
- Fabricación de contactos para generadores eléctricos.
- Elaboración de yoduro de plata, utilizado como antiséptico y en la industria fotográfica.
- Creación de aleaciones con fines odontológicos, como las amalgamas, e insumos para soldadura o baterías eléctricas, como las de plata-cadmio.
- Producción de mezclas con fines medicinales, como el nitrato de plata, utilizado para disminuir o eliminar las verrugas.
Plata en la tabla periódica
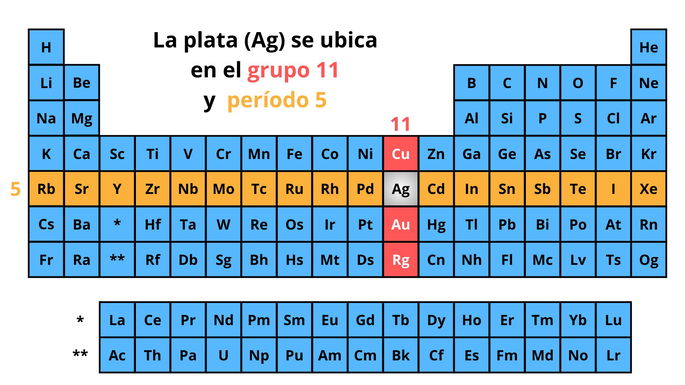
La plata es un metal de transición que pertenece a la familia del cobre (Cu), es decir, al grupo 11 de la tabla periódica. Además de la plata y el cobre, en esta familia se incluyen el oro (Au) y el roentgenio (Rg).
La plata se encuentra en el período 5, que es una agrupación de elementos que presentan 5 capas de electrones. Dentro de este período, la plata se posiciona entre el paladio (Pd) y el cadmio (Cd).
Veamos algunas propiedades y detalles sobre la plata que suelen divulgarse en la tabla periódica:
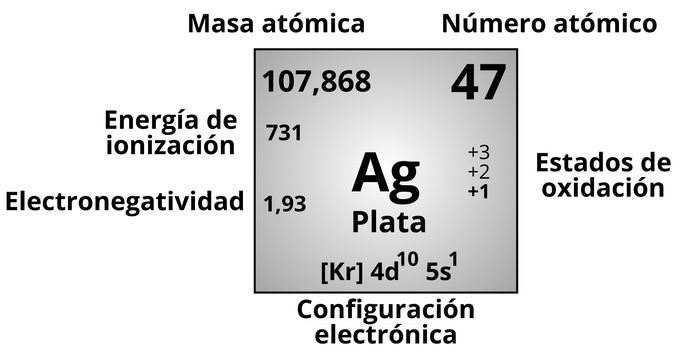
Símbolo: Ag, ya que proviene del latín argentum.
Número atómico: 47. Este valor equivale a la cantidad de protones que posee este elemento, así como el número de electrones cuando no está ionizado.
Masa atómica: 107,868 uma (unidad de masa atómica) para el isótopo más estable de la plata. La masa atómica es la suma de masas de los protones, neutrones y electrones. Por ello, podemos deducir que la plata contiene 61 neutrones en el isótopo más estable.
Energía de ionización: 731 kJ/mol. Esto nos indica cuánta energía debemos aplicar sobre la plata para separar de él el electrón más alejado del núcleo atómico.
Electronegatividad: 1,93 según la escala de Pauling. Es relativamente alta comparada con la electronegatividad de la mayoría de elementos metálicos.
Estados de oxidación: el oro puede tener tres estados de oxidación diferentes (obviando el 0), siendo el más común +1, es decir, que suele ceder un electrón.
Configuración electrónica: [Kr] 4d10 5s1. La configuración electrónica de la plata parte de la del kriptón (Kr), con 36 electrones, y luego muestra dónde se ubican los otros 11 electrones. Podemos ver que solo presenta un electrón en la última capa y subcapa (5s).
Propiedades químicas y físicas de la plata
Otras propiedades físicas y químicas a destacar de la plata son:
- Densidad: de 10,49 g/cm3 o 10.490 kg/m3, alrededor de 10,5 veces más densa que el agua.
- Punto de fusión: 961,78 °C.
- Punto de ebullición: 2162 °C.
- N.º de electrones de valencia: 1 electrón. Se halla prácticamente libre, por lo que es fácil que la plata ceda el electrón al combinarse con otros elementos.
- Dureza: 2,5 MPa en la escala de Mohs, con un valor máximo de 10, por lo que concluimos que está entre los metales más blandos.
- Radio atómico: 165 pm.
- Conductividad térmica: 429 W/m·K, la más alta de todos los elementos en su estado puro.
- Conductividad eléctrica: 62 MS/m, la más alta de los metales.
- Calor específico: 235 J/kg·K.
- Entalpía de vaporización: 250,58 kJ/mol.
- Entalpía de fusión: 11,3 kJ/mol.
Efectos de la plata en la salud
Si bien la plata tiene múltiples aplicaciones industriales y artesanales, se trata de un metal que debe ser manipulado con normas mínimas de seguridad para evitar el contacto directo con sus componentes de forma prolongada.
Estos son algunos efectos de la plata sobre el organismo:
Argiria: es una condición caracterizada por una excesiva coloración de la piel, que se torna gris o azulada, debido a la acumulación de sales o componentes de plata en el organismo.
Daños oculares, ocasionados por el contacto directo de la mucosa con la plata en estado líquido.
Daños digestivos o respiratorios debido al contacto con los vapores resultantes de los procesos químicos a los que es sometida la plata.
Afecciones cardíacas o del sistema nervioso central, generadas por la sobreexposición a la plata o sus compuestos.
Vea también:
Cómo citar: Rhoton, Stephen (13/02/2024). "Plata (Ag)". En: Significados.com. Disponible en: https://www.significados.com/plata/ Consultado:










