Oro (Au)
El oro, de símbolo Au, es un elemento químico de número atómico 79. Se trata de un metal precioso, de color amarillo y brillante, y es considerado actualmente como uno de los elementos más valiosos.
Este elemento se halla en la naturaleza en su estado sólido y en pequeñas cantidades, usualmente como pepitas de oro. Se conserva bien con el tiempo gracias a su resistencia a la oxidación y que no reacciona con un gran número de compuestos químicos. Debido a esto, el oro se ha convertido en un símbolo de poder económico y riqueza.

Desde hace más de 5000 años, el oro ha sido utilizado para numerosos fines. Por ejemplo, en el Antiguo Egipto y la América precolombina, este metal fue trabajado para fabricar utensilios, joyas, artefactos y esculturas de oro con fines ceremoniales y ornamentales.
A lo largo de los milenios, el oro ha servido para elaborar joyería y acuñar monedas, y como reserva de valor. Al ser un metal muy dúctil y maleable, es fácil de trabajar con él, manipularlo y darle forma.
Su extracción se lleva a cabo a través del proceso de lixiviación con cianuro. Sin embargo, esta técnica resulta perjudicial y muy tóxica para el medio ambiente. No obstante, en los ríos se suele aplicar la técnica del bateo que resulta menos nocivo para el ecosistema.
La palabra oro deriva del latín aurum, que significa ‘brillante amanecer’.
Propiedades y características del oro
La densidad del oro es de 19,3 g/cm3 o 19.300 kg/m3. Es una de las más altas de todos los metales, situándose detrás de pocos elementos como el platino, iridio, plutonio y neptunio.
El oro se halla siempre en su estado sólido en la corteza terrestre. No es posible hallarlo en la naturaleza en su estado líquido o gaseoso, ya que su punto de fusión es de 1064 °C, mientras que el punto de ebullición es de 2856 °C.
Otra propiedad a destacar del oro es que es poco reactivo e inalterable por el aire, la humedad y el calor. Posee una alta resistencia a la oxidación y ante diversos agentes químicos, por lo que no se corroe fácilmente, pero sí reacciona con cloruros, cianuros y bromuros.
El oro posee más propiedades y características, como:
- Es un buen conductor del calor y la electricidad.
- Posee un color amarillo brillante cuando se encuentra en su estado puro, pero con aleaciones puede cambiar un poco de tonalidad.
- Destaca por su escasez en la naturaleza, lo que contribuye a su alto valor económico.
- Se conoce por ser bastante blando y fácil de trabajar con él, pues es el metal más dúctil y maleable que existe.
- Debido a su alta densidad, el oro es un elemento muy pesado.
- No se disuelve ante casi ningún solvente. Una de las pocas sustancias capaces de disolver el oro es el agua regia, una disolución corrosiva compuesta por ácido nítrico y ácido clorhídrico.
- No es un elemento magnético. Para que el oro presente propiedades magnéticas, es necesario alearlo con un metal magnético como hierro o níquel.
Para qué se utiliza el oro
El oro es un metal que es ampliamente utilizado en diversas áreas, sobre todo en el área de la joyería, la fabricación de monedas y la industria electrónica. También forma parte de las reservas e inversiones económicas de los países.

Gran parte del oro extraído se utiliza para elaborar joyas, especialmente en la creación de alianzas y anillos de compromiso. No obstante, es común servirse del oro para los collares, brazaletes, cadenas, diademas, coronas, e incluso ornamentaciones lujosas en muebles.
El oro tiene un gran valor económico. Un gran número de países se sirve de este elemento para fabricar monedas, aunque usualmente se mezcla con otros metales. Además, el oro es vital para la reserva de valor de bastantes países, ya que su valor no fluctúa mucho y se ve poco afectado por la inflación.
Otros usos que se hacen del oro son:
- Fabricación de medallas, como las olímpicas.
- Elaboración de artículos del hogar, como cubiertos, vasos y platos.
- Creación de partes de instrumentos musicales, como en flautas traveseras finas.
- Fabricación de conexiones eléctricas gracias a su conductividad y resistencia a la oxidación.
- Creación de motores de aviones.
- Sirve como recubrimiento protector en la fabricación de satélites.
- En cosmética, el oro es un ingrediente en algunas cremas faciales.
- En la odontología, se utiliza el oro en la elaboración de prótesis y amalgamas dentales.
- En medicina, se emplea para elaborar medicamentos terapéuticos y en el tratamiento del cáncer.
El oro como elemento de la tabla periódica
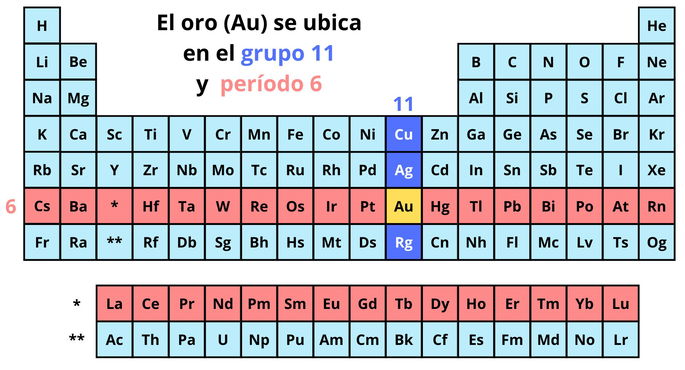
El oro es un elemento que pertenece a la familia del cobre (Cu), es decir, al grupo 11 de la tabla periódica, y forma parte de los metales de transición. Además del oro y el cobre, en esta familia se incluyen la plata (Ag) y el roentgenio (Rg).
Asimismo, el oro se ubica en el período 6, ya que forma parte de los elementos que presentan 6 capas de electrones. Dentro de este período, se posiciona entre el platino (Pt) y el mercurio (Hg).
Veamos en profundidad algunos detalles sobre el oro que suelen mostrarse en la tabla periódica:
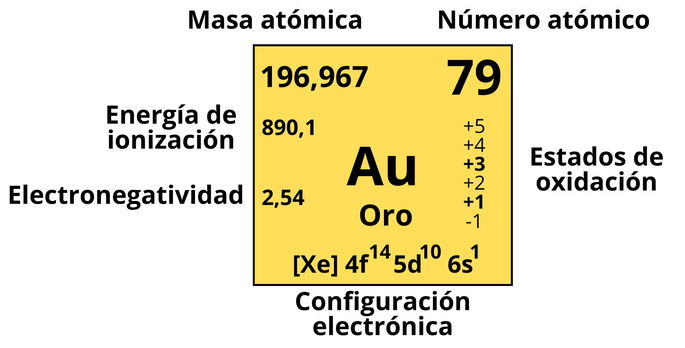
- Símbolo: Au.
- Número atómico: 79, un número que equivale a la cantidad de protones que posee este elemento, así como a la cantidad de electrones cuando no está ionizado.
- Masa atómica: 196,967 uma (unidad de masa atómica) para el isótopo más estable del oro. La masa atómica es la suma de masas de los protones, neutrones y electrones. De aquí podemos concluir que el oro, en su isótopo estable, posee 118 neutrones.
- Energía de ionización: 890,1 kJ/mol, que nos indica cuánta energía se debe aplicar sobre el oro para separar de él el electrón más alejado del núcleo atómico.
- Electronegatividad: 2,54 según la escala de Pauling, la más alta de los metales, por lo que es el elemento metálico con la mayor probabilidad de atraer un electrón.
- Estados de oxidación: el oro puede tener seis estados de oxidación diferentes (obviando el 0), siendo los más comunes +1 y +3, es decir, que suele ceder 1 o 3 electrones.
- Configuración electrónica: [Xe] 4f14 5d10 6s1. Esta representación parte de la configuración electrónica del xenón (Xe), con 54 electrones, y luego muestra dónde se ubican los otros 25 electrones. Podemos ver que solo presenta un electrón en la última capa y subcapa (6s).
Aleaciones del oro con otros metales
El oro se puede mezclar con diversos metales para obtener diferentes niveles de dureza y colores distintos, y adquirir otras propiedades. Es común alearlo con plata, cobre, paladio, platino, hierro y níquel, aunque hay otras composiciones posibles.
Las aleaciones de oro más populares suelen ser de 18 quilates, que son aquellas que poseen 75% de oro. Algunos ejemplos son:
- Oro amarillo, que contiene 75% de oro, 15% de plata y 10% de cobre. También existe la variante con 10% de plata y 15% de cobre.
- Oro blanco, que suele contener 75% de oro y 25% de platino, paladio, o una mezcla de ambos elementos. También existe otra variante que combina zinc, paladio y níquel en distintas proporciones.
- Oro rosa, compuesto por 75% de oro, 20% de cobre y 5% de plata. Para lograr un tono más rosado, a veces se incrementa la proporción de cobre a 22,25% y se disminuye la de la plata a 2,75%.
- Oro rojo, que contiene 75% de oro y 25% de cobre.
- Oro azul, fabricado con 75% de oro y 25% de hierro. La presencia de hierro otorga a la aleación propiedades magnéticas.
- Oro verde, compuesto por 75% de oro y 25% de plata. También puede contener un pequeño porcentaje de cobre e incluso otros elementos metálicos, como el cadmio.
También te puede interesar:
Cómo citar: Rhoton, Stephen (08/02/2024). "Oro (Au)". En: Significados.com. Disponible en: https://www.significados.com/oro-au/ Consultado:










