Orbitales atómicos
El orbital atómico es la región y espacio energético que se encuentra alrededor del núcleo atómico. Dentro de esa zona, existe una mayor probabilidad de encontrar un electrón, el cual realiza movimientos ondulatorios.
Los átomos están compuestos por protones y neutrones, así como por una nube electrónica en la zona extra-nuclear. Ahí, los electrones se mueven alrededor del núcleo, ocupando orbitales de diversas formas y niveles de energía.
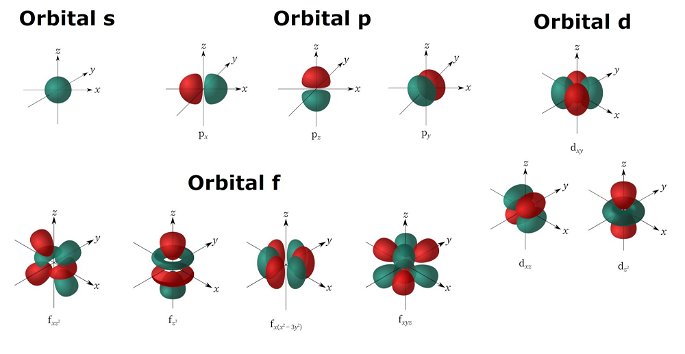
Algunos ejemplos de orbitales s, p, d y f, con orientaciones diferentes.
Cada tipo de orbital puede albergar un número de electrones específico. Por ejemplo, el orbital s puede contener hasta 2 electrones por cada nivel de energía, mientras que el orbital p alberga hasta 6 electrones.
Si tomamos el oxígeno como referencia, este elemento posee 8 electrones y una configuración electrónica de 1s2 2s2 2p4. Dicha configuración indica que hay 2 electrones en el orbital 1s, otros 2 en el orbital 2s y los últimos 4 en el orbital 2p.
Ver también: Configuración electrónica y Átomo
Tipos de orbitales atómicos
Podemos predecir la disposición de los electrones, pero no sus posiciones exactas, debido al comportamiento ondulatorio. La ecuación de Schrödinger nos permite aproximar la posición de los electrones utilizando tres números cuánticos: n, l y m.
Con estos números, podemos saber qué tipos de orbitales atómicos hay en un elemento:
- La letra “n” es el número cuántico principal, e identifica el nivel de energía y tamaño del orbital. Se representa como 1, 2, 3, etc.
- La letra “l” indica el subnivel de energía y tipo o forma del orbital. Se representa con números desde el 0 hasta n - 1. A cada número se le ha asignado una letra:
- l = 0 es "s".
- l = 1 es "p".
- l = 2 es "d".
- Etc.
- La letra “m” se emplea para referirse al número cuántico magnético, que indica la orientación espacial del orbital. Este número puede ser igual a 0 o un número entero, tanto positivo como negativo, hasta el valor de l (+1/-1, +2/-2, +3/-3, etc.).
Orbital s

Su nombre deriva del inglés Sharp, que significa ‘nítido’. Este orbital se caracteriza por tener una forma esférica, y puede albergar hasta 2 electrones. El valor del número cuántico secundario que lo define es l = 0, y su número cuántico magnético es m = 0. Por lo tanto, no tiene subniveles de energía ni presenta distintas orientaciones.
Los orbitales 1s y 2s se tienen que llenar de electrones antes de ir al siguiente tipo de orbital.
Orbital p
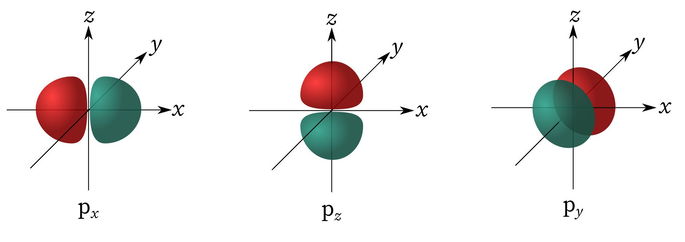
Su nombre deriva del inglés Principal. Consta de dos lóbulos que se proyectan a lo largo de un eje, ambos con la misma forma pero orientación opuesta. El valor del número cuántico secundario que lo define es l =1, y puede contener hasta 6 electrones.
El orbital p puede tener tres orientaciones distintas, indicadas con los números cuánticos magnéticos m = -1, m = 0, y m = 1.
Orbital d
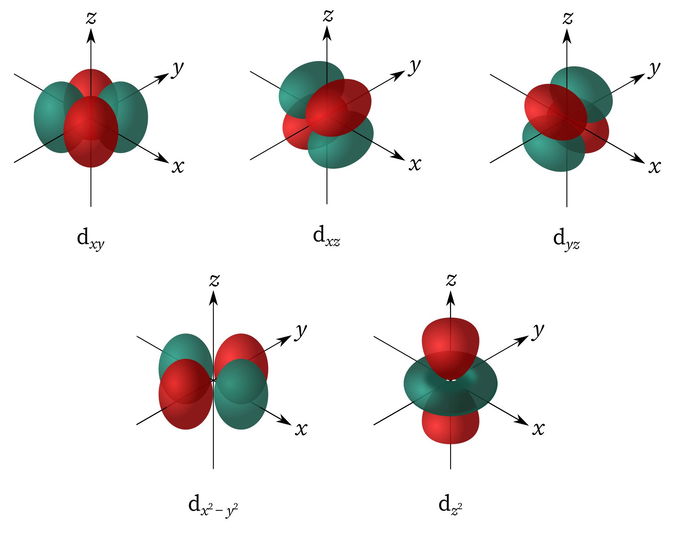
Su nombre deriva del inglés Diffuse. Se caracteriza por tener múltiples formas y puede haber hasta 10 electrones. El valor de su número cuántico secundario es l = 2, y sus números cuánticos magnéticos m son -2, -1, 0, 1 y 2.
Orbital f
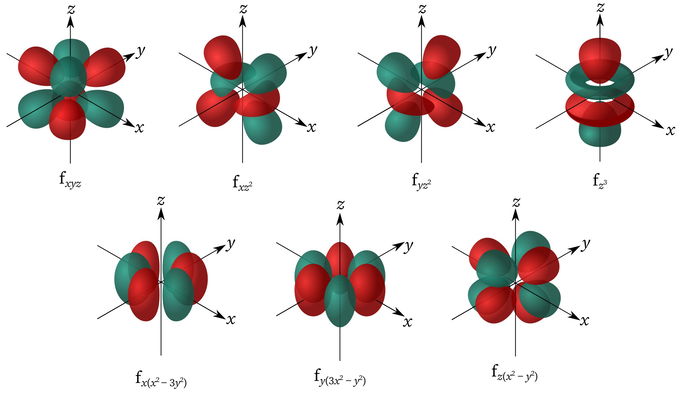
Su nombre deriva del inglés Fundamental. Este orbital tiene forma multilobular y puede tener hasta 14 electrones. El valor de su número cuántico secundario es l = 3, y el número cuántico magnético puede ir desde el 0 hasta el +3/-3.
Vea también:
Cómo citar: (24/02/2025). "Orbitales atómicos". En: Significados.com. Disponible en: https://www.significados.com/orbital-atomico/ Consultado: