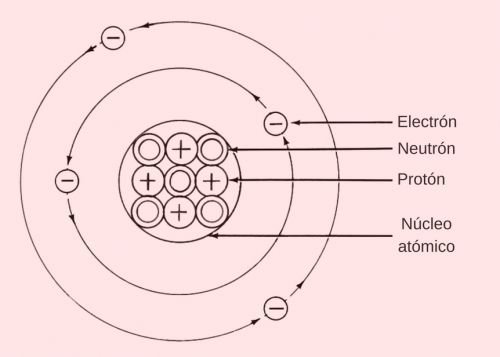
Núcleo atómico
El núcleo atómico es el centro del átomo, alrededor del cual los electrones orbitan. Está compuesto de protones y neutrones, y posee casi la totalidad de la masa del átomo.
Ernest Rutherford (1871-1937) dedujo en 1911 la existencia del núcleo atómico. Al lanzar partículas alfa a una lámina de oro, observó que algunas rebotaban en direcciones distintas. Eso le llevó a entender que los átomos contienen un núcleo denso con carga positiva, donde la mayor parte de la masa se concentra.
Más adelante, en 1932, James Chadwick descubrió la existencia de los neutrones. A partir de ahí, se establece que el átomo está formado por electrones y un núcleo atómico compuesto por protones y neutrones.
La importancia del núcleo atómico radica en que constituye la mayor parte másica de un átomo. Además, sus protones indican el tipo de elemento químico que se observa, y el número de neutrones, el isótopo del elemento.
Hoy en día, se conoce la existencia de partículas elementales o subatómicas: los leptones, cuarks y bosones. En concreto, los protones y neutrones se componen de varios tipos de cuarks. Veamos la estructura del núcleo.
Estructura del núcleo atómico
El núcleo atómico es de carga positiva y está compuesto por nucleones. A su vez, los nucleones se dividen en protones y neutrones.
Por un lado, los protones tienen una carga eléctrica positiva, y están formados por dos cuarks arriba y un cuark abajo. Por el otro, los neutrones son de carga neutra, y están compuestos por un cuark arriba y dos cuarks abajo.
Ambos tipos de partículas tienen el mismo tamaño, y están fuertemente unidos en el núcleo atómico. Los protones y neutrones no están quietos, sino que se mueven dentro del núcleo.
Vea también Neutrón, Protón, Electrón y Modelos atómicos.
Propiedades y características del núcleo atómico
En el núcleo atómico se reúne toda la carga positiva y la mayoría de la masa del átomo. Se describe como un núcleo muy pequeño y denso, ocupando solo una parte diminuta del átomo, con electrones orbitando en la nube electrónica.
Los nucleones, compuestos de protones y neutrones, están unidos por la fuerza fundamental más fuerte conocida: la fuerza nuclear fuerte. Es así que los nucleones se mantienen compactados y unidos, difíciles de separar.
El número de protones presente en el núcleo indica el número atómico del elemento químico. Por ejemplo, el hidrógeno es contiene 1 protón, mientras que el oxígeno tiene 8. Por lo tanto, la cantidad de protones en un átomo nos informa de qué elemento se trata.
El número de protones también equivale al número de electrones que hay en un átomo estable. No obstante, el átomo puede ganar o perder electrones, convirtiéndose así en un ion. Por ejemplo, si hay menos electrones que protones, el átomo será un ion positivo.
Aunque los protones y neutrones del núcleo están emparejados, hay elementos con varios isótopos. Los isótopos son átomos que poseen diferentes cantidades de neutrones, sin variar el número de protones. Muchos de los isótopos con más neutrones que protones suelen ser estables, pero poco abundantes.
Uno de los isótopos más conocidos es el carbono-14 o 14C, usado para la datación de la materia orgánica. Este isótopo del carbono tiene 6 protones, pero 8 neutrones, lo que suma 14.
Para terminar, el hidrógeno es el único elemento con núcleo atómico compuesto solamente por un protón. Todos los demás elementos contienen protones y neutrones. Es por eso que el helio, el segundo elemento de la tabla, pesa cuatro veces más que el hidrógeno, pues tiene 2 protones y 2 neutrones.
También te puede interesar:
Cómo citar: Rhoton, Stephen (21/11/2023). "Núcleo atómico". En: Significados.com. Disponible en: https://www.significados.com/nucleo-atomico/ Consultado:









