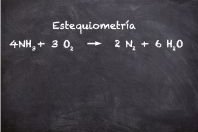Qué es un mol en química
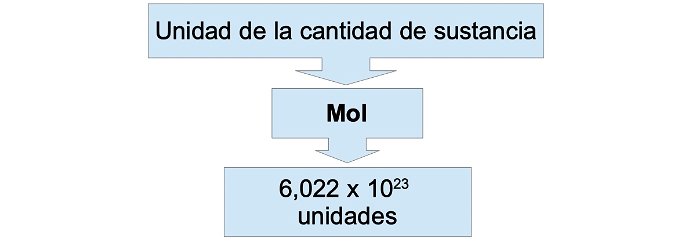
Un mol es la unidad que expresa la cantidad de una sustancia en el Sistema Internacional (SI). Un mol contiene 6,022 x 10 23 unidades o elementos. Por ejemplo:
- Un mol de átomos de hidrógeno contiene 6,022 x 10 23 átomos de hidrógeno.
- Un mol de agua H2O contiene 6,022 x 10 23 moléculas de agua.
- Un mol de electrones es igual a 6,022 x 10 23 electrones.
Un mol contiene un número fijo de elementos, así como una docena siempre tiene 12 elementos. Por ejemplo, cuando hablamos de una docena de huevos, sabemos que son 12 huevos; si fuera un mol de huevos, entonces tendríamos 6,022 x 10 23 huevos.
El concepto de mol en química fue actualizado por el Comité Internacional para los Pesos y Medidas en 2019. La definición anterior de mol era "la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos en 12 gramos de carbono 12".
La masa de un mol es lo que se conoce como masa molar. Así, cada mol de un elemento químico, molécula o partícula tiene una masa determinada. Por ejemplo, 1 mol de hidrógeno tendrá una masa de 1,008 gramos, mientras 1 mol de oro tiene una masa de 196,96657 gramos.
Vea también Número de Avogadro, Masa molar, Molécula, Átomo, Estequiometría
Referencias
BIPM, The International System of Units (2019) SI Brochure-Mise en pratique for the definition of the mole in the SI. Appendix 2. 9.ed.
Bindel, T.H. (2021) Introducing High School Students to the Avogadro Number and the Mole Concept Using Discovery with Calculations Based on physical properties of elements, crystal Structures, and 28Si Spheres. J.Chemical Education 98: 790-795
Cómo citar: Fernandes, Ana (09/02/2023). "Qué es un mol en química". En: Significados.com. Disponible en: https://www.significados.com/mol/ Consultado: