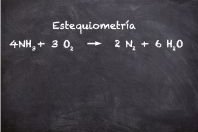Ley de la Conservación de la Materia
La ley de la conservación de la materia es la que sostiene que, dentro de un sistema cerrado, la cantidad de materia que interviene en una reacción química es constante.
Entendemos por sistema cerrado un entorno que aísla del exterior los componentes implicados en la reacción, como puede ser un recipiente sellado.
Cuando la transformación se realiza a través de un proceso físico, tampoco se observa alteración en las masas.
Dicho de otra forma, si llenamos un recipiente con agua y lo congelamos, la cantidad de agua no aumenta ni disminuye, únicamente cambia su estado de líquido a sólido.
El proceso no altera la masa de los elementos que participan en la reacción, solo provoca una nueva organización en su estructura. Vamos a tener la misma cantidad de materia al inicio y al final de dicha reacción.
El enunciado que mejor describe lo que postula esta ley es:
“En la naturaleza nada se crea ni se destruye, todo se transforma” (A. Lavoisier, 1785)
La ley de la conservación de la materia se desarrolla en el siglo XVIII gracias a dos científicos, Mijaíl Lomonósov y Antoine Lavoisier, que, de manera paralela, alcanzaron conclusiones similares.
Numerosos hechos de nuestro día a día demuestran lo que sostiene este principio básico de la química.
Ejemplos de la ley de la conservación de la materia
A continuación exponemos algunas situaciones que confirman esta ley:
La descomposición de la fruta
Es notable la reducción del tamaño del alimento a medida que se degrada. Esa materia se transforma en gases que se liberan en el ambiente.
Fundir hielo
Al dejar un vaso con hielo a temperatura ambiente, el hielo se derrite. La cantidad de sustancia que queda en el recipiente es la misma, solo se altera su estado.
Hervir agua
La ebullición del agua nos sirve también de ejemplo, ya que cuando hierve, el agua se consume y se transforma en vapor, que permanece en el ambiente.
Objetos oxidados
Los objetos metálicos, generalmente de hierro, se oxidan debido a su exposición al oxígeno. El oxígeno reacciona con el metal generando una capa de óxido en su superficie.

Formación de compuestos
En la formación del agua, dos moléculas de hidrógeno (2 H2) reaccionan con una molécula de oxígeno (O2) dando lugar a dos moléculas de agua (2H2O). Como vemos en la imagen, el número total de átomos entre reactantes y productos no varía, hay cuatro átomos de hidrógeno y dos átomos de oxígeno a cada lado de la reacción.

Ver también:
Descubrimiento de la ley de la conservación de la materia
El descubrimiento de esta ley tiene lugar en el siglo XVIII ante la preocupación existente en la comunidad científica por la pérdida de materia en determinados procesos como la combustión.
En 1748 Mijaíl Lomonósov, estudioso destacado en diferentes artes y ciencias, realizó la primera formulación de esta ley.
“En una reacción química la materia se conserva, siendo la masa inicial igual a la masa resultante” (M. Lomonósov, 1748)
Años más tarde, en 1785, Antoine Lavoisier, letrado, economista y científico francés, reformuló la ley aportando nuevos matices.
“Los elementos que participan en una reacción química conservan cada uno su propia masa después de la reacción” (A. Lavoisier, 1785)
Por esta razón la ley de la conservación de la materia también se conoce como la ley de Lomonósov-Lavoisier.
Ambos científicos emplearon, por primera vez, métodos para medir y pesar de manera precisa, lo que supuso un importante avance para la química y contribuyó al descubrimiento de sus leyes fundamentales.
Cómo citar: Significados, Equipo (17/07/2024). "Ley de la Conservación de la Materia". En: Significados.com. Disponible en: https://www.significados.com/ley-de-la-conservacion-de-la-materia/ Consultado: