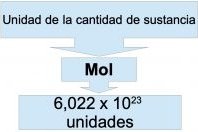
Estequiometría
La estequiometría es la información de las cantidades de los reactantes y productos en una reacción química. Esta se basa en que la cantidad de reactantes es igual a la cantidad de los productos y que los compuestos tienen una composición fija.
La palabra "estequiometría" deriva del griego stoicheon (elemento) y metron (medida). Fue aplicada por Jeremias Benjamin Richter en 1792.
Un coeficiente estequiométrico es el número que aparece delante de la fórmula química en una ecuación. Por ejemplo, en la reacción de descomposición del agua H2O se produce hidrógeno H2 y oxígeno O2 en forma de gas:
En este caso, el H2O y el H2 tienen un 2 como coeficiente estequiométrico, mientras el O2 no tiene ningún coeficiente. Esto significa que 2 moléculas de H2O se transforman en 2 moléculas de H2 y 1 molécula de O2.
La estequiometría está presente en la vida cotidiana. Cuando hacemos un pastel, tenemos que usar unas cantidades fijas de ingredientes (reactantes) para obtener un pastel (producto). Si utilizamos más polvo de hornear que harina, el resultado probablemente no será el deseado.
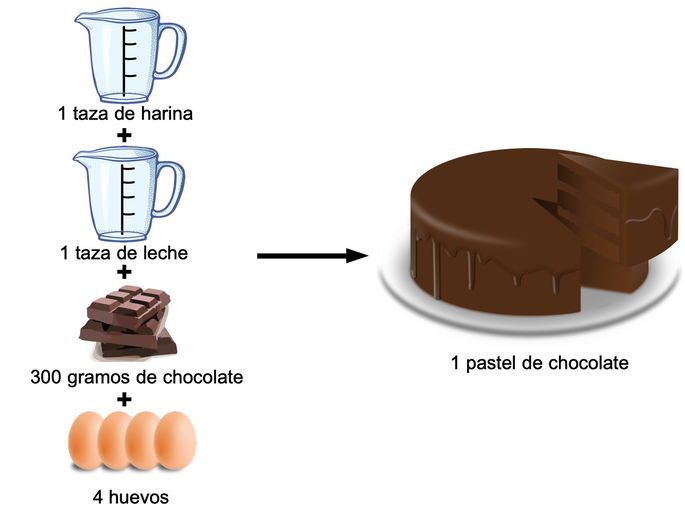
Para preparar un pastel de chocolate, debemos emplear unas cantidades fijas de harina, leche, chocolate, huevos y otros ingredientes. Esto es aplicar la estequiometría en nuestro día a día.
Cálculos estequiométricos
Los cálculos estequiométricos son la manera en que se ajustan los coeficientes estequiométricos para que una ecuación química esté balanceada. Existen varios métodos, siendo el método por tanteo y el método algebraico los más utilizados.
Cálculo estequiométrico para balancear una ecuación por tanteo
Este método se basa en ir probando paso a paso cuáles son los coeficientes estequiométricos correctos para balancear una ecuación química.
Por ejemplo, en la combustión de metano CH4 en presencia de oxígeno O2 (reactantes) se produce dióxido de carbono CO2 y agua H2O, como se muestra en la siguiente ecuación:
En primer lugar, revisamos cuántos átomos de cada elemento se encuentran a cada lado de la ecuación:
Podemos notar que el carbono está en la misma cantidad de cada lado de la ecuación, pero el oxígeno y el hidrógeno no. Tanteamos colocando un 2 como coeficiente delante del agua en los productos y un 2 delante del O2 en los reactantes:
Ahora sí tenemos la misma cantidad de elementos del lado izquierdo (reactantes) y del lado derecho (productos) de la ecuación química. Es decir, la ecuación está balanceada.
Cálculo estequiométrico por método algebraico
Este método utiliza la matemática para determinar los coeficientes estequiométricos. Para esto se asignan letras a cada coeficiente y se hace un sistema de ecuaciones.
Relaciones estequiométricas
Las relaciones estequiométricas indican cuánto de cada reactante se necesita para obtener una dada cantidad de producto.
Por ejemplo, en la reacción del nitrato de bismuto Bi(NO3)3 con sulfuro de sodio Na2S, produce sulfuro de bismuto y nitrato de sodio, como se muestra en la ecuación:
En esta ecuación, la relación estequiométrica establece que 2 moléculas de Bi(NO3)3 reaccionan con 3 moléculas de Na2S y se produce 1 molécula de Bi2S3 y 6 moléculas de NaNO3.
Vea también:
Referencias
Atkins, P., Jones, L., Laverman, L. (2016) Chemical Principles: the quest for insight. 7ed. W.H.Freeman. New York.
Szabadvary, F. (1962) The birth of stoichiometry. J.Chem.educ. 39:267-270
Cómo citar: Fernandes, Ana (13/02/2023). "Estequiometría". En: Significados.com. Disponible en: https://www.significados.com/estequiometria/ Consultado: