Enlaces químicos
Un enlace químico es una fuerza de atracción que une átomos y moléculas que comparten, atraen o ceden electrones. También es aquella unión que se da cuando dos átomos o moléculas presentan polaridades opuestas.
A través de los enlaces químicos, se pueden formar moléculas tan pequeñas, compuestas solo de dos átomos, hasta macromoléculas que contengan decenas de átomos. Estos enlaces se dan tanto en moléculas orgánicas como inorgánicas; por lo tanto, los enlaces químicos son los responsables de formar las sustancias tal y como las conocemos.
Los átomos se sirven de los enlaces químicos para alcanzar la estabilidad en su configuración electrónica. Los gases nobles como el neón o el argón, al ser los elementos más estables, no reaccionan con otros. El resto de elementos sí son reactivos, por lo que establecen enlaces entre ellos para tener una configuración electrónica similar a la de los gases nobles.
Una vez producido el enlace, no es posible separar los componentes de la molécula sin la intervención de procesos químicos, o un cambio brusco en el medio.
Pongamos el metano (CH4) como ejemplo, una molécula que se compone de 1 átomo de carbono y 4 de hidrógeno. La capa de valencia del carbono está formada por 4 electrones. Para alcanzar la estabilidad electrónica, precisa de 4 electrones más para tener 8 en la capa de valencia, como el gas noble neón.
El hidrógeno solo posee 1 electrón en la capa de valencia. En este caso, solo necesita 1 electrón más para poseer una configuración electrónica similar al helio, que tiene 2 electrones en dicha capa.
Cuando se forma el metano, lo que sucede es que el carbono y los hidrógenos comparten sus electrones, de forma que el carbono termina con 8 electrones, y cada hidrógeno con 2 electrones. De esta manera, todos los átomos de las moléculas alcanzan la estabilidad electrónica deseada.
Ahora, la manera de alcanzar la estabilidad en la configuración electrónica varía según la naturaleza de los átomos.
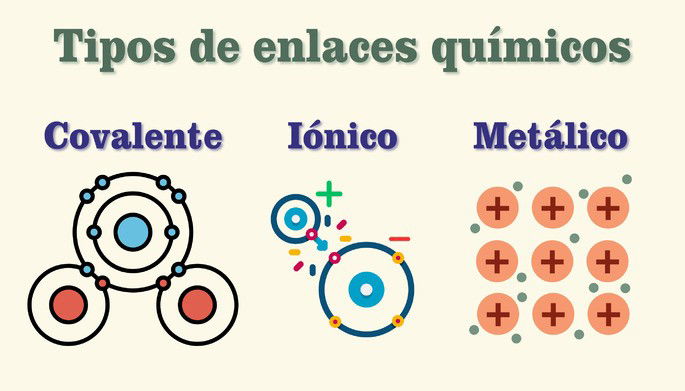
Tipos de enlaces químicos
Existen tres tipos principales de enlaces químicos según las características de los átomos que se enlazan: los covalentes, iónicos y metálicos. Además, hay otros enlaces que suceden entre moléculas que merecen mencionarse.
Enlaces covalentes
Los enlaces covalentes son aquellos que se forman entre átomos no metálicos, como el hidrógeno, oxígeno, carbono o nitrógeno. Estos enlaces se caracterizan en que los átomos comparten electrones para alcanzar una configuración electrónica estable.
Para que se dé un enlace covalente entre dos átomos, la diferencia de electronegatividad entre ambos ha de ser menor de 1,7 en la escala de Pauling. Es decir, la capacidad de atraer electrones ha de ser similar.
Cuando la variación de electronegatividad entre los dos átomos es de 0,4 o menor, se trata de un enlace covalente no polar o apolar. Los átomos comparten los electrones y los atraen con una fuerza de atracción similar.
Por otro lado, hablamos de enlaces covalentes polares cuando la variación de electronegatividad entre átomos es entre 0,4 y 1,6. En este caso, los electrones son atraídos con mayor fuerza por el átomo más electronegativo, pero sin producir iones positivos o negativos. En su lugar, se genera una carga parcial negativa y positiva.
Además de enlaces covalentes polares y no polares, se pueden formar enlaces simples, dobles y triples según la cantidad de electrones que se comparten.
Algunos ejemplos de compuestos unidos por enlaces covalentes son:
- la glucosa (C6H12O6);
- el oxígeno molecular (O2);
- el nitrógeno molecular (N2);
- el amoniaco (NH3);
- el metano (CH4);
- el agua (H2O);
- y el dióxido de carbono (CO2).
Vea también Enlace covalente.
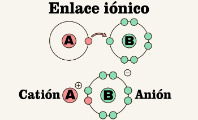
Enlaces iónicos
Los enlaces iónicos o electrovalentes son enlaces que se forman entre átomos metálicos y no metálicos. Para que se produzca este enlace, la diferencia de electronegatividad entre los átomos ha de ser mayor que 1,7 en la escala de Pauling.
A raíz de la variación de electronegatividad, en los enlaces iónicos se producen iones; de ahí el nombre. El átomo más electronegativo es el que atrae el electrón con más fuerza, convirtiéndose así en un anión o ion negativo. El átomo menos negativo, en cambio, es el que pierde o cede el electrón, convirtiéndose así en un catión o ion positivo.
Debido a la naturaleza de los enlaces iónicos, las moléculas formadas de esta forma son buenos conductores de la electricidad. Asimismo, la unión entre átomos es mucho más fuerte que en los enlaces covalentes, lo que implica puntos de fusión y ebullición más altos.
Ejemplos de enlaces iónicos son:
- el yoduro de potasio (KI);
- el carbonato de calcio (CaCO3);
- el nitrato de calcio (Ca(NO3)2);
- el sulfato de magnesio (MgS);
- el cloruro de manganeso (MnCl2);
- el óxido de magnesio (MgO);
- y el sulfuro de hierro (Fe2S3).
Vea también Enlace iónico.
Enlaces metálicos
Los enlaces metálicos son aquellos que se forman entre varios átomos metálicos de un mismo elemento. En este caso, lo que sucede es que los átomos se juntan formando una estructura sólida, estable y compacta llamada red metálica.
Estos enlaces suceden porque los átomos metálicos liberan electrones de valencia, generando así una nube de electrones libres entre átomos. Los átomos metálicos se convierten en cationes, y estos atraen electrones que se mueven alrededor de ellos.
Como varios átomos pueden atraer un mismo electrón en un momento dado, se forma así la estructura compacta. Se produce así uno de los enlaces más fuertes en la naturaleza, con una gran capacidad de conducir electricidad y calor.
Algunos ejemplos de elementos que se unen mediante enlaces metálicos son las barras de oro (Au), de plata (Ag) o de hierro (Fe), así como yacimientos de cadmio (Cd), cobre (Cu), plomo (Pb) o níquel (Ni).
Otros tipos de enlaces químicos
Además de los enlaces covalentes, iónicos y metálicos, existen otras fuerzas de atracción entre moléculas. Estas interacciones intermoleculares se denominan Fuerzas de Van der Waals, en honor al físico neerlandés Johannes Diderik van der Waals.
Las Fuerzas de Van der Waals son los puentes de hidrógeno, las fuerzas de dispersión de London y las interacciones dipolo-dipolo. Estos enlaces son más débiles que los covalentes, iónicos y metálicos, por lo que son más fáciles de romper.
Puentes de hidrógeno
También llamados enlaces de hidrógeno, son aquellas interacciones intermoleculares en las que al menos una molécula contiene hidrógeno. Este elemento, al enlazarse a otros átomos, suele tener una ligera carga positiva, y por ello, puede atraer cargas negativas de otras moléculas.
Pongamos el agua (H2O) como ejemplo. Los dos hidrógenos se unen al oxígeno compartiendo el único electrón que tienen. Como el oxígeno es bastante más electronegativo que el hidrógeno, este atrae con más fuerza los electrones de los hidrógenos. A raíz de esto, los hidrógenos poseen una carga parcial positiva.
En el agua hay varias moléculas de H2O muy próximas entre sí. Como el oxígeno posee una carga parcial negativa, se genera una fuerza de atracción con hidrógenos de otras moléculas de H2O, formando así los puentes de hidrógeno.
Fuerzas de dispersión de London
Las fuerzas de dispersión de London son un fenómeno parecido a los puentes de hidrógeno, pero con otros elementos. Cuando se forma una molécula, los electrones compartidos, donados o recibidos no se mantienen quietos, sino que se mueven con el tiempo.
Este movimiento de electrones provoca que los átomos presenten una carga parcial negativa o positiva en regiones alrededor del núcleo atómico. Por un instante breve, los átomos atraen a otras moléculas cercanas con carga parcial opuesta, juntando ambas moléculas.
Cabe decir que la atracción producida por las fuerzas de dispersión de London son poco duraderas, debido al movimiento continuo de electrones.
Interacción dipolo-dipolo
Las interacciones dipolo-dipolo se producen entre moléculas formadas por átomos con gran diferencia de electronegatividad. Esta variación de electronegatividad provoca una polaridad en la molécula, creando una región de carga negativa y otra de carga positiva.
Cuando se acercan dos moléculas que presentan estas características, la región negativa de una molécula atrae la región positiva de la otra. Si se juntan varias de estas moléculas, se puede formar una red cristalina y estable en condiciones naturales, aunque frágil ante impactos físicos.
Este tipo de interacción intermolecular sucede principalmente entre moléculas cuyos átomos se unen mediante enlaces iónicos y enlaces covalentes polares.
Características generales de los enlaces químicos
Cada tipo de enlace químico posee sus propias características. No obstante, hay propiedades que comparten, como:
- Al formarse los enlaces, los átomos siempre ceden, ganan o comparten electrones de la capa de valencia, que es la capa de electrones más externa de un átomo.
- Cuando se unen dos átomos mediante un enlace químico, su naturaleza no cambia, es decir, siguen siendo los mismos elementos. Lo que sí cambia temporalmente es la configuración electrónica.
- Los enlaces químicos suceden principalmente por la diferencia de electronegatividad entre los átomos.
- Para establecer los enlaces químicos, es necesario emplear energía que provenga del medio o de otras reacciones. Al romper estos enlaces, se libera energía al medio.
- Los enlaces pueden ocurrir de forma natural o mediante cambios en el medio. Por ejemplo, subidas o bajadas de temperatura y presión, cambios en el pH del medio, la aplicación de electricidad o la presencia de otras sustancias.
- La estabilidad del enlace químico depende de la naturaleza de los átomos implicados, el tipo de enlace que se produzca y el medio en el que se encuentran.
- Dependiendo de los elementos que se unen en el enlace químico, la molécula estará dotada de unas propiedades químicas y físicas u otras.
Vea también Configuración electrónica y Orbitales atómicos.
Cómo citar: Rhoton, Stephen (19/03/2025). "Enlaces químicos". En: Significados.com. Disponible en: https://www.significados.com/enlaces-quimicos/ Consultado: