Enlace Iónico
Un enlace iónico, también llamado enlace electrovalente, es un tipo de enlace químico que ocurre cuando un átomo cede un electrón al otro, a fin de que ambos alcancen estabilidad electrónica.
Esta unión se produce entre elementos metales y no metales con diferente electronegatividad, lo que significa que los elementos tienen diferente capacidad para donar o atraer electrones. En general, los elementos metales están dispuestos a donar un electrón, mientras que los no metales están dispuestos a tomarlo.
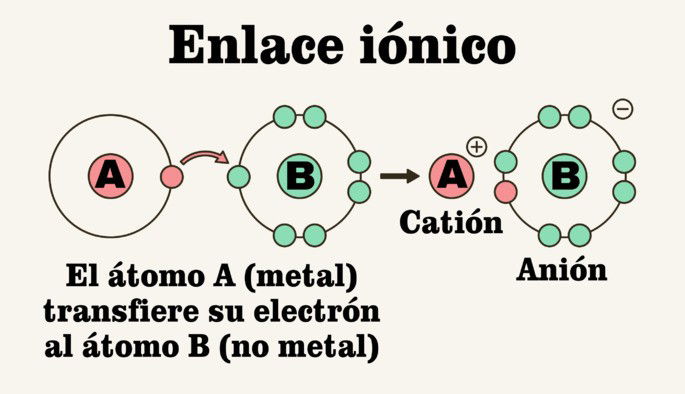
Reciben el nombre de enlaces iónicos porque producen iones en su proceso. Cuando ocurre la transferencia de electrones entre los átomos, el donador se convierte en un ion positivo llamado catión, lo que significa que adquiere carga positiva. Por su parte, el receptor se transforma en un ion negativo llamado anión.
Los enlaces iónicos son uno de los tres tipos de enlaces químicos que existen, junto a los enlaces covalentes y los enlaces metálicos. Los iónicos son los enlaces más comunes que intervienen en la formación de compuestos inorgánicos.
Algunos ejemplos de moléculas con enlaces iónicos son el cloruro de sodio (NaCl), el óxido de cobre II (CuO), el nitrato de plata (AgNO3), el carbonato de calcio (CaCO3) y el cromato de hierro II (FeCrO4).
Características de los enlaces iónicos
Las características de los enlaces iónicos se relacionan con los elementos que intervienen en ellos, el proceso de unión y su resultado.
Una de las principales es que el enlace iónico se produce siempre entre elementos metales, sobre todo los del grupo 1 y 2, y no metales, como los del grupo 15, 16 y 17 en la tabla periódica. Estos enlaces son simples, es decir, no se forman dobles ni triples enlaces.
Los átomos que forman estos enlaces han de tener grandes diferencias de electronegatividad entre sí. Si la diferencia de electronegatividad entre ambos es mayor que 1,7 según la Escala de Pauling, se producirá el enlace iónico. Si es menor, se trata de un enlace covalente.
Asimismo, los enlaces iónicos son siempre producto de una transferencia de electrones. Como resultado, los átomos se transforman en cationes y aniones tras esta transferencia, dando lugar un enlace fuerte y rígido debido a la atracción de cargas negativas y positivas.
Los compuestos formados por enlaces iónicos presentan una serie de propiedades como resultado de la fuerte atracción entre cargas que se produce en dichos enlaces, determinando su comportamiento químico.
A continuación enumeramos algunas de estas propiedades:
- Son neutros en estado sólido: cuando están en estado sólido, la carga eléctrica de los enlaces iónicos es neutra.
- Suelen cristalizarse: debido a la estructura tridimensional de un enlace iónico, estos favorecen redes cristalizadas frágiles.
- Altos puntos de ebullición y fusión (300º C a 1000º C): como existe una fuerza de atracción muy potente entre los iones, estos deben someterse a altos puntos de fusión o ebullición para modificar su estado.
- Sólidos en temperaturas entre 20º C y 30º C: en consecuencia de lo anterior, los enlaces iónicos suelen ser sólidos a temperatura ambiente.
- Buenos conductores de electricidad: los enlaces iónicos son buenos conductores de electricidad siempre que estén disueltos en agua.
Vea también Enlaces químicos y Tabla periódica.
Cómo se forma un enlace iónico
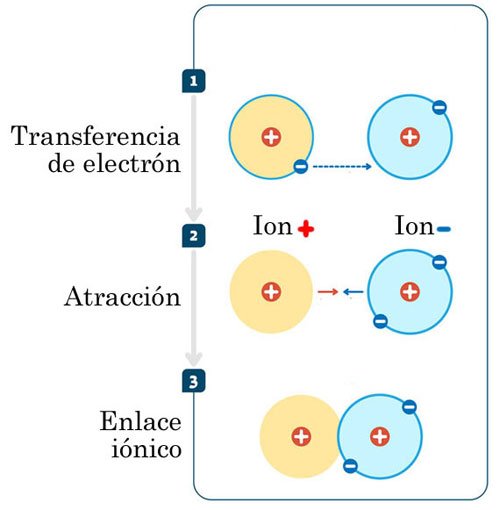
Cuando un elemento metal y otro no metal se aproximan, buscan la estabilidad electrónica. Para ello, el metal estará dispuesto a donar un electrón de valencia de su capa más externa, mientras que el no metal estará dispuesto a recibir dicho electrón en la misma capa.
Esta transferencia de electrones sucede por la diferencia de electronegatividad entre los metales y los no metales. En general, un metal es menos electronegativo que un no metal, por lo que tiene tendencia a perder electrones. Los no metales tienden a ganar electrones, especialmente aquellos con electronegatividad muy alta, como el cloro, flúor, oxígeno o nitrógeno.
Una vez que el elemento metal transfiere su electrón, el átomo adquiere una carga positiva, esto es, se convierte en un catión o un ion positivo. Por su parte, el no metal adquiere una carga negativa al recibir el electrón, convirtiéndose así en un anión o ion negativo.
Las cargas positiva y negativa de los iones generan inmediatamente una fuerza de atracción que los une. Así, se consolida un enlace iónico.
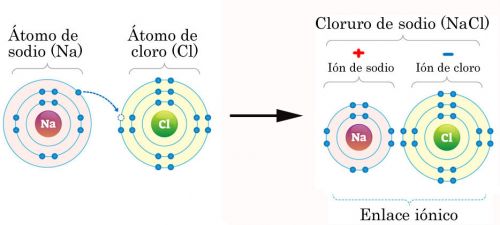
Por ejemplo, el sodio (Na) tiene un electrón de valencia en la última capa electrónica, mientras que el cloro (Cl) tiene siete. Cuando el sodio y el cloro se aproximan, el sodio cede su electrón al cloro. Este, suma entonces 8 electrones de valencia.
Cuando el sodio pierde su electrón, gana una carga positiva y se convierte en un catión. Cuando el cloro gana un electrón, se vuelve negativo y se convierte en un anión.
Dado que las cargas positivas y negativas se atraen, ambos iones se unen formando un enlace iónico. Este compuesto en particular, formado a partir de enlaces iónicos, es cloruro de sodio (NaCl), nombre químico de la sal de mesa.
Ver también Ion y Configuración electrónica.
Ejemplos de enlaces iónicos
A continuación, presentamos un listado de ejemplos de moléculas con átomos unidos mediante enlaces iónicos:
- Bromuro de potasio (KBr), un componente de medicamentos homeopáticos, sedantes, anticonvulsivo, diurético, etc.
- Carbonato de calcio (CaCO3), de usos médicos como antiácido, digestivo, entre otros.
- Cloruro de amonio (NH4Cl), que sirve como base de fertilizante.
- Cloruro de magnesio (MgCl2), que sirve como componente de anticongelantes.
- Cloruro de manganeso (MnCl2), usado en la producción de pinturas, barnices, desinfectantes, etc.
- Cloruro de sodio (NaCl), cuyo nombre común es la sal de mesa.
- Dicromato de potasio (K2Cr2O7), usado en la fabricación de pigmentos, tratamiento del cuero, tratamiento de metales, etc.
- Fluoruro de litio (LiF), usado en la fabricación de vidrios, cristales, esmaltes y cerámicas.
- Fosfato disódico (Na2HPO4), muy usado como estabilizador de productos cárnicos.
- Hidróxido de potasio (KOH), que se usa en jabones, detergentes, fertilizantes, etc.
- Hidróxido de zinc (Zn(OH)2), muy usado para tratamientos cutáneos, como cremas y bronceadores.
- Hipoclorito de sodio (NaClO), útil en la desinfección del agua.
- Ioduro de potasio (KI), usado como base de la sal yodada.
- Nitrato de calcio (Ca(NO3)2), que se emplea en el tratamiento de aguas residuales.
- Nitrato de plata (AgNO3), una sustancia que permite detectar cloruro en otras soluciones, y sirve también como cauterizante de lesiones diversas.
- Óxido de Calcio (CaO), conocido comúnmente como cal.
- Óxido de hierro II (FeO), que sirve como base para pigmentos de cosméticos y tintes corporales.
- Óxido de magnesio (MgO), un laxante y antiácido, normalmente conocido como leche de magnesia.
- Sulfato de cobre (CuSO4), que sirve como fungicida, para limpiar piscinas y como componente de la alimentación animal.
- Sulfato de potasio (K2SO4), que tiene aplicaciones como fertilizante y es un componente de algunos materiales de construcción.
Diferencia entre enlaces iónicos y enlaces covalentes
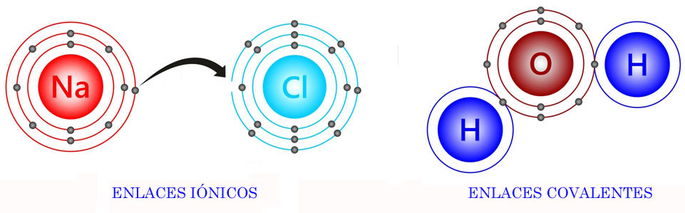
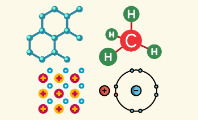
A la izquierda, podemos ver al sodio (Na) transfiriendo un electrón al cloro (Cl) para formar sal común (NaCl). Esto es un enlace iónico.
A la derecha, vemos un átomo de oxígeno compartiendo un par de electrones con dos átomos de hidrógeno para formar la molécula de agua (H2O). Aquí se da el enlace covalente.
La diferencia más importante entre enlaces iónicos y covalentes reside en que los enlaces iónicos transfieren un electrón de un átomo al otro. En cambio, en los enlaces covalentes los átomos comparten electrones, por lo que no hay ninguna transferencia. En otras palabras, ningún átomo recibe o da electrones.
Otra diferencia es que los enlaces iónicos se producen normalmente entre elementos metales y no metales. En cambio, los enlaces covalentes solo se establecen entre elementos no metales.
Una tercera diferencia radica en el tipo de compuestos que generan ambos enlaces. La mayor parte de los compuestos inorgánicos están constituidos por enlaces iónicos. Por su parte, los compuestos orgánicos siempre se forman con enlaces covalentes, ya que en su mayoría solo contienen elementos no metálicos.
Te puede interesar:
Cómo citar: Rhoton, Stephen (12/03/2025). "Enlace Iónico". En: Significados.com. Disponible en: https://www.significados.com/enlace-ionico/ Consultado: