Enlace covalente
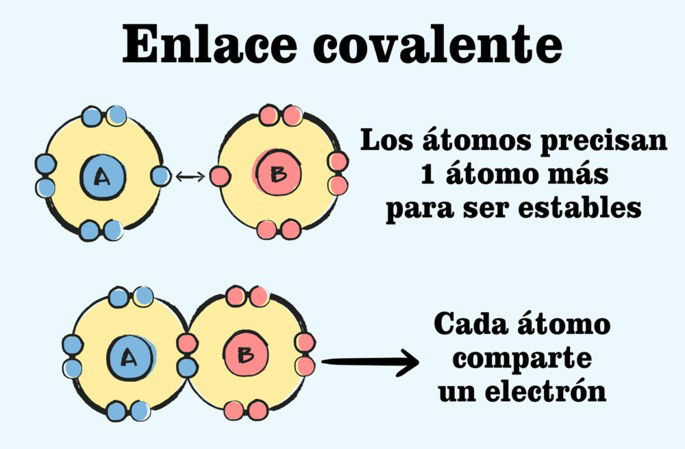
Un enlace covalente es una fuerza que une a dos átomos de elementos no metálicos para formar una molécula. Lo fundamental en esa unión es el hecho de que los átomos comparten pares de electrones de su capa más superficial, llamada capa de valencia, para lograr la estabilidad de la molécula que se ha formado con el enlace.
A la tendencia de los elementos de alcanzar una configuración estable se le conoce como regla del octeto. Esta es fundamental para la formación de enlaces covalentes y otros tipos de enlaces químicos, como los iónicos.
Dependiendo de la capacidad de los átomos para atraer electrones, los enlaces covalentes pueden ser polares o no polares. También pueden ser simples, dobles o triples, según la cantidad de electrones que comparten.
Los enlaces covalentes están presentes en las biomoléculas orgánicas, como las proteínas, los carbohidratos o los ácidos nucleicos. Algunos ejemplos de otras moléculas que contienen enlaces covalentes son:
- El oxígeno molecular (O2), en el que ambos átomos de oxígeno se unen mediante un enlace covalente doble.
- El ácido clorhídrico (HCl), en el que un átomo de hidrógeno y otro de cloro comparten un electrón cada uno.
- El propino (C3H4), en el que dos de los carbonos presentan un enlace covalente triple, mientras que el resto de átomos se enlazan con enlaces simples.
- El agua (H2O), en el que los átomos de hidrógeno comparten un electrón cada uno con el oxígeno.
- El dióxido de carbono (CO2), en el que los dos átomos de oxígeno se enlazan con el carbono mediante enlaces dobles.
En 1916, Gilbert Newton Lewis descubrió la interacción de pares de electrones entre átomos de un enlace covalente. Eso sí, no fue hasta 1919 que Irving Langmuir introduciría el término de covalencia para referirse a este tipo de unión.
Características de los enlaces covalentes
Los enlaces covalentes solo se forman entre elementos no metálicos, como el oxígeno (O), hidrógeno (H), nitrógeno (N), etc. Debido a esto, es común que la diferencia de electronegatividad entre los átomos no sea muy alta.
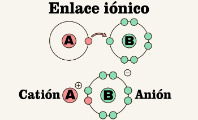
Para que un enlace covalente dé lugar, la diferencia de electronegatividad entre los átomos ha de ser menor que 1,7. Si es superior, el enlace será iónico, pues se producirá un transporte de electrones hacia el átomo más electronegativo.
Al producirse un enlace covalente, se desprende energía. Mientras más estable sea la unión de covalencia, más energía se libera al producirse el enlace; como consecuencia, es necesario suministrar energía para romper estos enlaces.
Los electrones de un enlace covalente se comparten siempre en pares, bien sea en:
- enlaces simples, en los que intervienen dos electrones;
- enlaces dobles, en los que intervienen cuatro electrones;
- o enlaces triples, en los que intervienen seis electrones.
Cuando hablamos de pares de electrones, nos referimos a que dos átomos enlazados aportan un electrón cada uno, creando así un par.
Los enlaces covalentes son más estables cuando son dobles o triples y no polares, es decir, cuando la electronegatividad de los átomos es similar.
Por un lado, si los átomos se unen solamente con enlace simple, la fuerza de atracción no será tan alta comparada con átomos unidos mediante enlaces dobles o triples. Por el otro, si hay una diferencia de electronegatividad, se produce el fenómeno de la polaridad. Las moléculas polares son más fáciles de disociarse.
Tipos de enlaces covalentes
Los enlaces covalentes se clasifican en función de la electronegatividad de los átomos del enlace y el número de electrones compartidos entre ellos.
Enlace covalente polar
Una molécula está compuesta por más de un átomo. Cuando hay un átomo que atrae a los electrones con mayor intensidad que el otro, se genera una mayor concentración de electrones en esa parte de la molécula. Este fenómeno se llama polaridad.
La parte de la molécula donde se concentran los electrones tiene una carga parcial negativa, mientras la otra región de la molécula tiene una carga parcial positiva.
Por eso, este tipo de enlace recibe el nombre de “polar”, porque hay una polarización o distribución poco equitativa de los electrones que conforman la molécula.
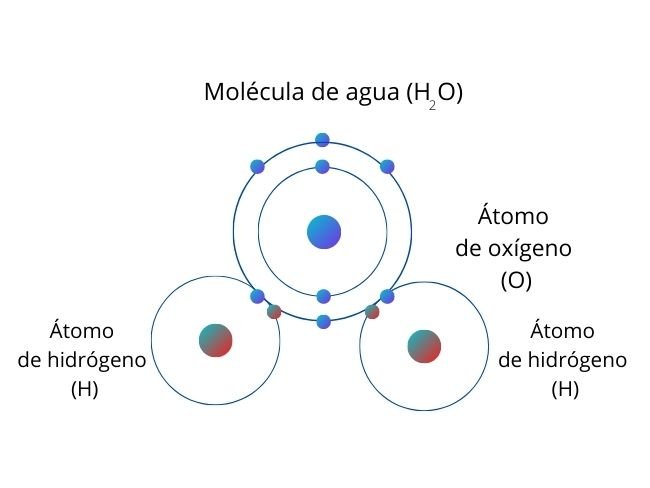
Por ejemplo, en una molécula de agua (H2O), el oxígeno atrae los electrones de hidrógeno con mayor fuerza. Por ello, hay mayor concentración de electrones en el lado del oxígeno, generando así una carga parcial negativa. Como los hidrógenos atraen los electrones con menor fuerza, en ese lado de la molécula hay una carga parcial positiva.
Para que un enlace covalente sea polar, la diferencia de electronegatividad entre los átomos ha de ser entre 0,5 y 1,6. Si es mayor, el enlace será iónico; si es menor, será covalente no polar, el cual comentamos a continuación.
Enlace covalente no polar
Un enlace covalente no polar ocurre cuando los pares de electrones se comparten entre átomos que tienen una electronegatividad igual o muy similar. Esto favorece una distribución equitativa de los electrones, es decir, ninguno de los átomos atrae los electrones con mayor fuerza que el otro.
En este caso, la diferencia de electronegatividad entre los átomos enlazados es de 0,4 o menos. Al no existir suficiente diferencia en la electronegatividad, la molécula no presenta el fenómeno de polaridad.
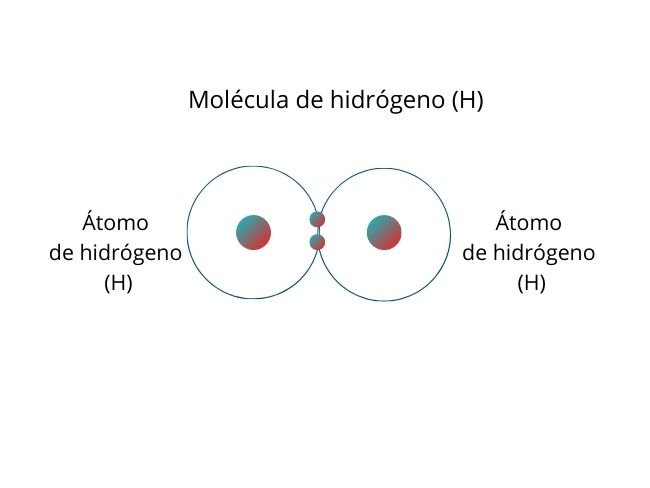
Por ejemplo, la molécula de hidrógeno (H2), compuesta por dos átomos de hidrógeno, es un ejemplo de enlace covalente no polar. Los átomos atraen los electrones con la misma fuerza, los cuales se mantienen en el centro de la molécula, por lo que no hay polaridad en la molécula.
Enlace covalente dativo o coordinado
En un enlace covalente dativo o coordinado, uno de los átomos en el enlace aporta sus electrones a otro de los átomos. El átomo que aporta dichos electrones se denomina átomo dativo, y el átomo que los recibe se denomina átomo receptor. Gráficamente, se identifica con una flecha desde el átomo dativo hacia el receptor, para indicar quién es el que aporta los electrones.
Esto suele pasar en moléculas que contienen iones positivos. Dada la menor cantidad o completa ausencia de electrones en la capa de valencia, es necesario que otro átomo aporte dos o más electrones para que se produzca el enlace.
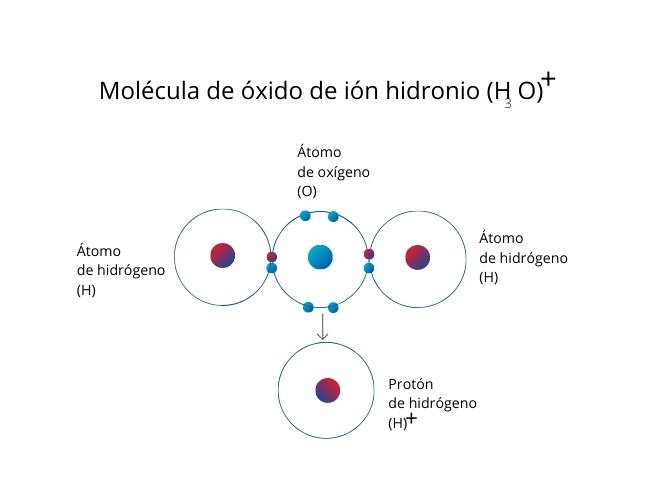
El caso de la molécula de hidrogenión o ion hidronio (H3O)⁺ es un ejemplo de este enlace. Aquí, el oxígeno aporta un par de electrones al ion de hidrógeno (protón), que no contiene electrones para establecer enlaces.
Aunque un átomo aporta electrones para suplir la deficiencia de electrones de otro átomo, no se trata de un enlace iónico, ya que para ello es necesaria una transferencia de electrones.
Enlace covalente simple
Un enlace covalente simple ocurre cuando cada átomo comparte un electrón para completar el par de electrones del enlace. Es decir, para que se dé el enlace covalente entre los átomos, solo se precisan dos electrones en total.
Este tipo de enlace covalente es menos estable, ya que se precisa menos energía para romper dicho enlace. Es también el que menos diferencia de electronegatividad se presenta entre los átomos, ya que solo intervienen dos electrones.
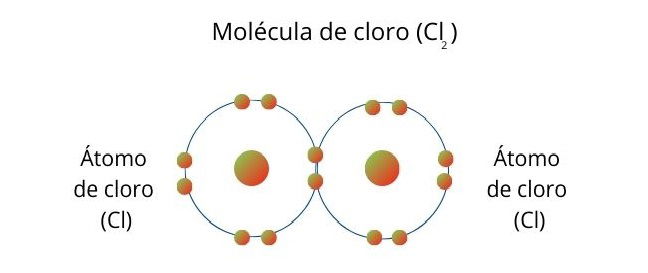
Por ejemplo, una molécula de cloro (Cl2) se forma cuando los átomos comparten un electrón para completar 8 electrones en su capa de valencia cada uno. De esta forma, los átomos alcanzan el máximo grado de estabilidad, según la regla del octeto.
Enlace covalente doble
Los enlaces covalentes dobles se generan cuando se comparten dos pares de electrones entre dos átomos, para un total de cuatro electrones compartidos.
Al haber más electrones involucrados, puede producirse el fenómeno de polaridad con mayor facilidad, en especial en aquellas moléculas que contengan tres átomos o más. Además, el enlace doble es más estable que el enlace simple, por lo que precisa más energía para romperse.
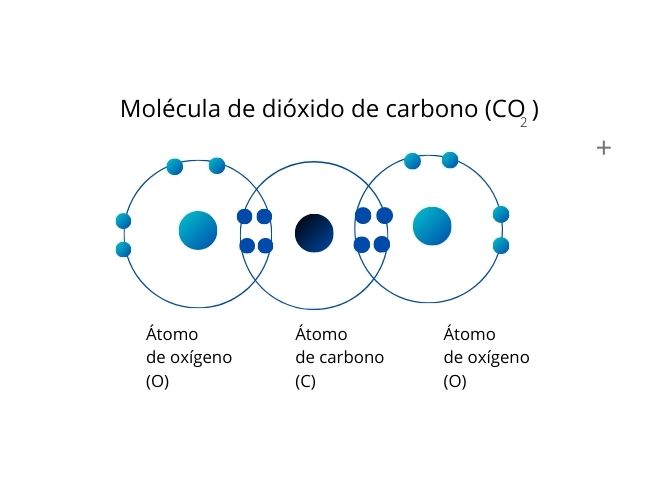
Un ejemplo es el dióxido de carbono (CO2), cuyos átomos de oxígeno comparten un par de electrones cada uno con el átomo de carbono. De esta forma, tanto los átomos de oxígeno como el de carbono poseen ocho electrones en la capa de valencia.
Enlace covalente triple
Un enlace covalente triple sucede cuando los átomos comparten seis electrones divididos en tres pares, formando así un enlace triple. Es el tipo de enlace menos común, el más estable y el que requiere mayor cantidad de energía para romperse.
En moléculas en las que intervienen tres átomos o más, la presencia del enlace covalente triple suele ser un indicador de polaridad. Al concentrarse muchos electrones en un solo punto de la molécula, implica que hay mayor carga parcial negativa en esa zona.
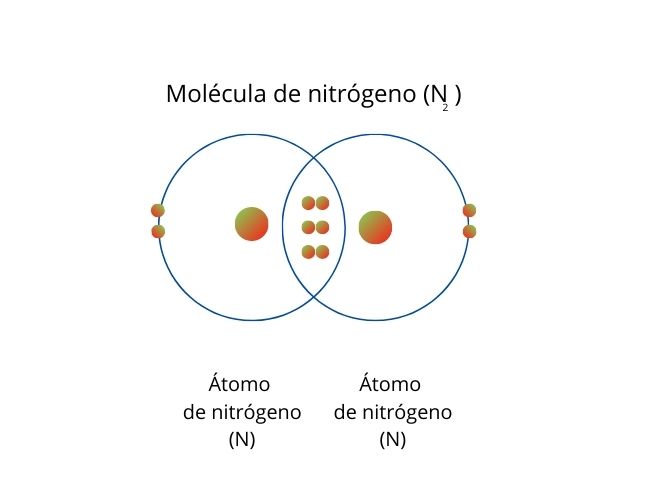
Un ejemplo es la molécula de nitrógeno (N2), cuyos átomos comparten tres pares de electrones. De esta forma, ambos tienen 8 electrones en la capa de valencia.
Vea también Enlaces químicos, Electrón y Tabla periódica.
La regla del octeto en los enlaces covalentes
Se conoce como regla del octeto a la tendencia que se observa en algunos elementos de la tabla periódica de alcanzar una configuración estable. Esta regla fue descubierta por el fisicoquímico Gilbert Newton Lewis en 1916.
Los átomos más estables de la tabla periódica son los gases nobles como el argón (Ar) o el neón (Ne), que tienen 8 electrones en su capa de valencia. Otros átomos tratan de alcanzar la estabilidad de los gases nobles reaccionando con otros átomos con quienes puedan compartir electrones hasta llegar a 8.
Un ejemplo es la molécula de cloro (Cl), que está compuesta por dos átomos. Cada uno de ellos tiene 7 electrones, por lo que cada átomo comparte un electrón para que el otro pueda llegar a 8 electrones.
La importancia de la regla del octeto es que, al conocer la tendencia que tienen los átomos para estructurarse, se puede predecir cómo se van a comportar al combinarse con otros elementos. Sin embargo, la regla del octeto tiene excepciones, ya que no se cumple con las moléculas que contienen berilio (Be) o boro (B), por ejemplo.
Quizá te interese leer:
Cómo citar: Rhoton, Stephen (12/03/2025). "Enlace covalente". En: Significados.com. Disponible en: https://www.significados.com/enlace-covalente/ Consultado: