Disolución
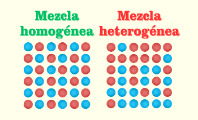
Una disolución es la mezcla homogénea de dos o más componentes que no reaccionan entre sí y que se encuentran en proporciones variables.
Las disoluciones tienen dos componentes: un solvente o disolvente, que es en el que se disolverá el soluto, y que generalmente está presente en mayor proporción. Por su parte, el soluto, es el compuesto que se disolverá en la mezcla.
En las disoluciones, no se aprecian a simple vista los componentes que las forman. El soluto, al estar disuelto en el solvente, se mezcla completamente y forma así una mezcla homogénea que no presenta fases diferenciadas.
El término disolución proviene del latín dissolutĭo, que alude a la acción y efecto de disolver.
Tipos de disolución y ejemplos
Las disoluciones se clasifican según su estado de agregación y su concentración. En ambos casos, existen varias subclasificaciones.
Disoluciones según el estado de agregación del solvente
Según el estado de agregación del solvente o disolvente, podemos hablar de diferentes tipos de disolución. Si el solvente se encuentra en estado sólido, tenemos:
- Sólido en sólido: el ejemplo más común son las aleaciones (combinaciones de dos o más elementos metálicos), como el cobre y el zinc, que dan como resultado latón.
- Gas en sólido: hidrógeno disuelto en paladio (se utiliza como una forma de almacenamiento de hidrógeno).
- Líquido en sólido: mercurio líquido mezclado con plata (se utiliza en el área odontológica para hacer las amalgamas).
Si el solvente se halla en estado líquido, podemos hablar de:
- Líquido en líquido: alcohol en agua.
- Sólido en líquido: agua con azúcar.
- Gas en líquido: bebidas carbonatadas.
Por último, si el solvente está en estado gaseoso, los tipos son:
- Gas en gas: butano (una forma de combustible) disuelto en aire.
- Sólido en gas: naftalina sublimada en el aire.
- Líquido en gas: productos en aerosol.
Disoluciones según la concentración del soluto y solvente
Las disoluciones se clasifican acorde a cómo se mide la concentración del soluto y solvente. Aquí se diferencian dos grandes grupos: las disoluciones empíricas o cualitativas, y las disoluciones valoradas o cuantitativas.
En las disoluciones empíricas no se calcula exactamente la concentración de los componentes, sino que se determina aproximadamente la proporción. Se clasifican como:
- Disolución diluida: la cantidad de soluto es mínima en proporción con el disolvente, como el azúcar diluido en café.
- Disolución concentrada: la cantidad de soluto es considerable con respecto al disolvente, como la sal en el agua de mar.
- Disolución saturada: el soluto y el solvente están equilibrados. Las bebidas carbonatadas tienen una proporción equilibrada de dióxido de carbono en agua.
- Disolución sobresaturada: la cantidad de soluto es mayor a la que puede mezclarse con el disolvente. Los jarabes y caramelos tienen una sobresaturación de azúcar en un solvente líquido.
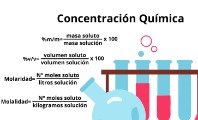
En las disoluciones valoradas, se considera la cantidad de los componentes de manera muy precisa. Esta medición puede hacerse en porcentaje de masa, moles (mol), volumen (centímetros cúbicos), gramos por litro (g/L).
Se subclasifican en tres grupos:
- Disoluciones valoradas iónicas: se realizan midiendo los iones de las disoluciones en que el soluto y el solvente forman enlaces iónicos con carga positiva (catión) y negativa (anión).
- Disoluciones valoradas elementales: son aquellas en que se extraen los componentes hasta obtenerlos en estado puro, para así medir las cantidades por separado.
- Disoluciones valoradas formuladas: en este caso, se considera el peso atómico de los componentes.
Características de una disolución
En términos generales, una disolución presenta algunas características distintivas. La primera es que siempre tiene por lo menos un soluto y un solvente. En algunos casos, la disolución puede contener varios solutos.
Cuando el soluto se disuelve, este pasa a formar parte del solvente. Por ejemplo, cuando el azúcar se disuelve en el agua, se convierte en parte de la mezcla.
Por esa razón, en una disolución los componentes no se pueden separar por centrifugación ni filtración. En cambio, la cristalización y la destilación nos permiten obtenerlos.
En una disolución, el volumen total es diferente a la suma de volúmenes de sus componentes. Esto sucede porque no son completamente aditivos. No obstante, las proporciones de solutos y solventes se mantienen iguales en todo momento.
Las proporciones de soluto y disolvente son variables, pero dentro de ciertos límites, pues la mezcla entre los componentes depende de la solubilidad de los mismos (cantidad de soluto que puede mezclarse con el solvente). Por ejemplo, una cuchara de azúcar puede disolverse en un vaso de agua, pero no ocurrirá lo mismo si a la misma cantidad de agua le agregamos un kilo de azúcar.
Al agregar un soluto a un disolvente, las características originales del segundo se modifican: disminuye su presión a vapor, su punto de congelación, y aumenta su punto de ebullición.
Ver también:
Cómo citar: Significados, Equipo (21/03/2025). "Disolución". En: Significados.com. Disponible en: https://www.significados.com/disolucion/ Consultado: