Configuración electrónica
La configuración electrónica de un elemento es una representación de la estructura electrónica del átomo. Nos muestra dónde se ubican los electrones en los distintos niveles y subniveles energéticos y orbitales que rodean el núcleo atómico.
Para los 118 elementos confirmados, los electrones se posicionan en siete niveles energéticos o capas. El primero, 1, es el de menor energía y más cercano al núcleo atómico. Conforme aumenta el nivel energético, los electrones tendrán más energía, pero estarán más alejados del núcleo.
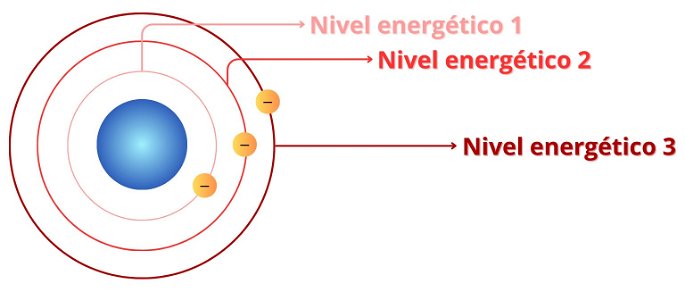
Representación simplificada de los tres primeros niveles energéticos.
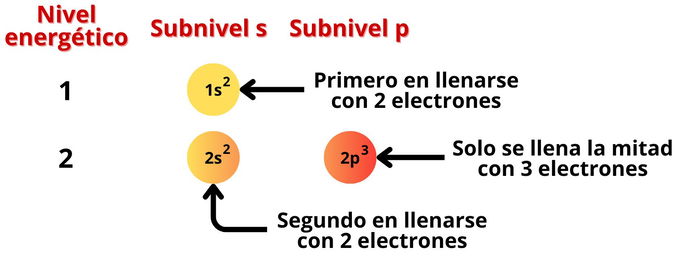
Dentro de cada nivel hay subniveles o subcapas que albergan electrones. Dependiendo del subnivel, podrá contener uno o más pares de electrones:
- Subnivel s: es el subnivel más pequeño. Contiene un orbital, por lo que puede albergar un par de electrones, con un total de 2.
- Subnivel p: contiene tres orbitales, por lo que puede albergar tres pares de electrones, con un total de 6.
- Subnivel d: contiene cinco orbitales, por lo que puede albergar cinco pares de electrones, con un total de 10.
- Subnivel f: contiene siete orbitales, por lo que puede albergar siete pares de electrones, con un total de 14.
Para saber en qué orden y cómo se colocan los electrones por niveles y subniveles, nos podemos servir del siguiente diagrama:
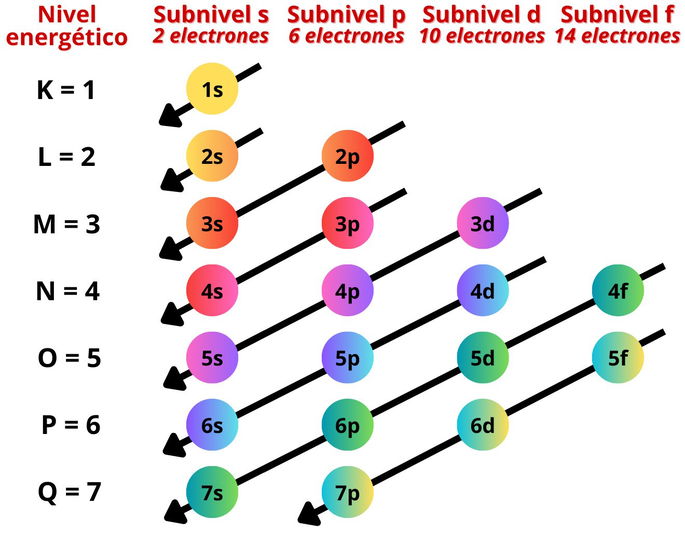
El diagrama está basado en el principio de Aufbau y la regla de ordenación de Madelung. En conjunto, ambos establecen que un átomo primero llena los niveles energéticos más bajos y subniveles más pequeños. Es decir, primero se llenará el nivel 1 y subnivel s, o 1s, antes del resto. Luego, los electrones ocuparán los subniveles 2s, 2p, 3s, 3p, 4s, etc.
Para ilustrar cuántos electrones hay en un subnivel, nos servimos del superíndice. Por ejemplo, si el subnivel 2p de un átomo contiene cinco electrones, lo representamos como 2p5. De esta forma, la configuración electrónica de un átomo nos informa tanto de la ubicación de los electrones como de la cantidad.
Para terminar, podemos emplear la notación de Kernel para simplificar configuraciones electrónicas usando los gases nobles como referencia. Por ejemplo, la configuración del sodio se escribe como 1s2 2s2 2p6 3s1 o [Ne] 3s1, tomando como referencia el neón.
Ejemplos de configuración electrónica
Configuración electrónica del nitrógeno
El nitrógeno es un elemento que, en su isótopo más estable y abundante, contiene 7 electrones y protones. Al haber más de dos electrones, eso implica que el primer nivel se llenará completamente. Por lo tanto, empezamos con 1s2, o sea, dos electrones emparejados.
Faltan 5 electrones por ubicar. Según el diagrama, el siguiente nivel y subnivel es el 2s. Como siguen quedando más de dos electrones, este nivel también se llena y obtenemos 2s2. Los últimos 3 electrones se colocan en el subnivel 2p, dando lugar a 2p3.
En resumen, la configuración electrónica del nitrógeno es 1s2 2s2 2p3, o [He] 2s2 2p3 según la notación de Kernel.
Configuración electrónica del calcio
El calcio es un elemento que posee 20 electrones y protones, por lo que es más pesado que el nitrógeno. Si partimos de la configuración electrónica anterior, vemos que podemos llenar los subniveles 1s2 2s2 2p6.
Los 10 electrones restantes se repartirán en los próximos subniveles. Si nos fijamos en el diagrama, vemos que los próximos tres subniveles son el 3s, 3p y 4s, los cuales suman un total de 10 espacios para electrones. Por lo tanto, estos subniveles también se llenan, dando lugar a 3s2 3p6 4s2.
Es decir, la configuración electrónica del calcio es 1s2 2s2 2p6 3s2 3p6 4s2, o [Ar] 4s2 según la notación de Kernel.
Configuración electrónica del bromo
El bromo contiene 35 electrones, o sea, 15 más que el calcio. Si miramos el diagrama, el próximo subnivel a llenarse tras completar la configuración del calcio es el 3d, con espacio para 10 electrones. Hay electrones de sobra, así que el subnivel se llenará, resultando en 3d10.
Los 5 electrones que quedan se colocan en el siguiente subnivel, 4p, todos emparejados excepto uno. Entonces, la configuración electrónica del bromo es 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5, o [Ar] 4s2 3d10 4p5 según la notación de Kernel.
Alternativamente, la configuración se escribe como 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5, intercambiando 4s2 por 3d10 para tener los niveles energéticos ordenados de menor a mayor.
Configuración electrónica de todos los elementos
Abajo mostramos una tabla con todos los elementos confirmados, así como sus configuraciones electrónicas. Escribimos dichas configuraciones según la notación de Kernel, para simplificar y facilitar la legibilidad.
En el caso de los gases nobles, enmarcados en negrita, sí escribimos su configuración electrónica completa.
| Número atómico | Nombre del elemento | Configuración electrónica |
|---|---|---|
| 1 | Hidrógeno | 1s1 |
| 2 | Helio | 1s2 |
| 3 | Litio | [He] 2s1 |
| 4 | Berilio | [He] 2s2 |
| 5 | Boro | [He] 2s2 2p1 |
| 6 | Carbono | [He] 2s2 2p2 |
| 7 | Nitrógeno | [He] 2s2 2p3 |
| 8 | Oxígeno | [He] 2s2 2p4 |
| 9 | Flúor | [He] 2s2 2p5 |
| 10 | Neón |
[He] 2s2 2p6 o 1s2 2s2 2p6 |
| 11 | Sodio | [Ne] 3s1 |
| 12 | Magnesio | [Ne] 3s2 |
| 13 | Aluminio | [Ne] 3s2 3p1 |
| 14 | Silicio | [Ne] 3s2 3p2 |
| 15 | Fósforo | [Ne] 3s2 3p3 |
| 16 | Azufre | [Ne] 3s2 3p4 |
| 17 | Cloro | [Ne] 3s2 3p5 |
| 18 | Argón |
[Ne] 3s2 3p6 o 1s2 2s2 2p6 3s2 3p6 |
| 19 | Potasio | [Ar] 4s1 |
| 20 | Calcio | [Ar] 4s2 |
| 21 | Escandio | [Ar] 3d1 4s2 |
| 22 | Titanio | [Ar] 3d2 4s2 |
| 23 | Vanadio | [Ar] 3d3 4s2 |
| 24 | Cromo | [Ar] 3d5 4s1 |
| 25 | Manganeso | [Ar] 3d5 4s2 |
| 26 | Hierro | [Ar] 3d6 4s2 |
| 27 | Cobalto | [Ar] 3d7 4s2 |
| 28 | Níquel | [Ar] 3d8 4s2 o [Ar] 3d9 4s1 |
| 29 | Cobre | [Ar] 3d10 4s1 |
| 30 | Zinc | [Ar] 3d10 4s2 |
| 31 | Galio | [Ar] 3d10 4s2 4p1 |
| 32 | Germanio | [Ar] 3d10 4s2 4p2 |
| 33 | Astato | [Ar] 3d10 4s2 4p3 |
| 34 | Selenio | [Ar] 3d10 4s2 4p4 |
| 35 | Bromo | [Ar] 3d10 4s2 4p5 |
| 36 | Kriptón |
[Ar] 3d10 4s2 4p6 o 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 |
| 37 | Rubidio | [Kr] 5s1 |
| 38 | Estroncio | [Kr] 5s2 |
| 39 | Itrio | [Kr] 4d1 5s2 |
| 40 | Circonio | [Kr] 4d2 5s2 |
| 41 | Niobio | [Kr] 4d4 5s1 |
| 42 | Molibdeno | [Kr] 4d5 5s1 |
| 43 | Tecnecio | [Kr] 4d5 5s2 |
| 44 | Rutenio | [Kr] 4d7 5s1 |
| 45 | Rodio | [Kr] 4d8 5s1 |
| 46 | Paladio | [Kr] 4d10 |
| 47 | Plata | [Kr] 4d10 5s1 |
| 48 | Cadmio | [Kr] 4d10 5s2 |
| 49 | Indio | [Kr] 4d10 5s2 5p1 |
| 50 | Estaño | [Kr] 4d10 5s2 5p2 |
| 51 | Antimonio | [Kr] 4d10 5s2 5p3 |
| 52 | Telurio | [Kr] 4d10 5s2 5p4 |
| 53 | Yodo | [Kr] 4d10 5s2 5p5 |
| 54 | Xenón |
[Kr] 4d10 5s2 5p6 o 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 |
| 55 | Cesio | [Xe] 6s1 |
| 56 | Bario | [Xe] 6s2 |
| 57 | Lantano | [Xe] 5d1 6s2 |
| 58 | Cerio | [Xe] 4f1 5d1 6s2 |
| 59 | Praseodimio | [Xe] 4f3 6s2 |
| 60 | Neodimio | [Xe] 4f4 6s2 |
| 61 | Prometio | [Xe] 4f5 6s2 |
| 62 | Samario | [Xe] 4f6 6s2 |
| 63 | Europio | [Xe] 4f7 6s2 |
| 64 | Gadolinio | [Xe] 4f7 5d1 6s2 |
| 65 | Terbio | [Xe] 4f9 6s2 |
| 66 | Disprosio | [Xe] 4f10 6s2 |
| 67 | Holmio | [Xe] 4f11 6s2 |
| 68 | Erbio | [Xe] 4f12 6s2 |
| 69 | Tulio | [Xe] 4f13 6s2 |
| 70 | Iterbio | [Xe] 4f14 6s2 |
| 71 | Lutecio | [Xe] 4f14 5d1 6s2 |
| 72 | Hafnio | [Xe] 4f14 5d2 6s2 |
| 73 | Tántalo | [Xe] 4f14 5d3 6s2 |
| 74 | Wolframio Tungsteno |
[Xe] 4f14 5d4 6s2 |
| 75 | Renio | [Xe] 4f14 5d5 6s2 |
| 76 | Osmio | [Xe] 4f14 5d6 6s2 |
| 77 | Iridio | [Xe] 4f14 5d7 6s2 |
| 78 | Platino | [Xe] 4f14 5d9 6s1 |
| 79 | Oro | [Xe] 4f14 5d10 6s1 |
| 80 | Mercurio | [Xe] 4f14 5d10 6s2 |
| 81 | Talio | [Xe] 4f14 5d10 6s2 6p1 |
| 82 | Plomo | [Xe] 4f14 5d10 6s2 6p2 |
| 83 | Bismuto | [Xe] 4f14 5d10 6s2 6p3 |
| 84 | Polonio | [Xe] 4f14 5d10 6s2 6p4 |
| 85 | Astato | [Xe] 4f14 5d10 6s2 6p5 |
| 86 | Radón |
[Xe] 4f14 5d10 6s2 6p6 o 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6 |
| 87 | Francio | [Rn] 7s1 |
| 88 | Radio | [Rn] 7s2 |
| 89 | Actinio | [Rn] 6d1 7s2 |
| 90 | Torio | [Rn] 6d2 7s2 |
| 91 | Protactinio | [Rn] 5f2 6d1 7s2 |
| 92 | Uranio | [Rn] 5f3 6d1 7s2 |
| 93 | Neptunio | [Rn] 5f4 6d1 7s2 |
| 94 | Plutonio | [Rn] 5f6 7s2 |
| 95 | Americio | [Rn] 5f7 7s2 |
| 96 | Curio | [Rn] 5f7 6d1 7s2 |
| 97 | Berkelio | [Rn] 5f9 7s2 |
| 98 | Californio | [Rn] 5f10 7s2 |
| 99 | Einstenio | [Rn] 5f11 7s2 |
| 100 | Fermio | [Rn] 5f12 7s2 |
| 101 | Mendelevio | [Rn] 5f13 7s2 |
| 102 | Nobelio | [Rn] 5f14 7s2 |
| 103 | Laurencio | [Rn] 5f14 7s2 7p1 |
| 104 | Rutherfordio | [Rn] 5f14 6d2 7s2 |
| 105 | Dubnio | [Rn] 5f14 6d3 7s2 |
| 106 | Seaborgio | [Rn] 5f14 6d4 7s2 |
| 107 | Bohrio | [Rn] 5f14 6d5 7s2 |
| 108 | Hasio | [Rn] 5f14 6d6 7s2 |
| 109 | Meitnerio* | [Rn] 5f14 6d7 7s2 |
| 110 | Darmstatio* | [Rn] 5f14 6d8 7s2 |
| 111 | Roentgenio* | [Rn] 5f14 6d9 7s2 |
| 112 | Copernicio* | [Rn] 5f14 6d10 7s2 |
| 113 | Nihonio* | [Rn] 5f14 6d10 7s2 7p1 |
| 114 | Flerovio* | [Rn] 5f14 6d10 7s2 7p2 |
| 115 | Moscovio* | [Rn] 5f14 6d10 7s2 7p3 |
| 116 | Livermorio* | [Rn] 5f14 6d10 7s2 7p4 |
| 117 | Teneso* | [Rn] 5f14 6d10 7s2 7p5 |
| 118 | Oganesón* |
[Rn] 5f14 6d10 7s2 7p6 o 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d10 6s2 6p6 5f14 6d10 7s2 7p6 |
* Estos elementos contienen configuraciones electrónicas predichas, no probadas.
Vea también Tabla periódica.
Otros detalles sobre las configuraciones electrónicas
Exceptuando el helio, todos los gases nobles terminan su configuración en Xs2 Xp6. Esta es la configuración electrónica más estable que puede tener un nivel energético, y es la razón por la que los gases nobles son poco reactivos.
El principio de exclusión de Pauli establece que dos partículas no pueden tener un mismo estado cuántico. Dos electrones en un mismo nivel y subnivel energético se diferencian por su espín o momento angular intrínseco, que puede ser +1/2 o -1/2. Al existir solo dos valores posibles, el orbital de un subnivel no admite más de dos electrones.
El principio de Aufbau y la regla de Madelung no se aplican a todos los elementos. En concreto, los metales de transición y varios de los elementos más pesados presentan configuraciones distintas a las esperadas. Veamos el caso del cromo.
Caso especial: configuración electrónica del cromo
El cromo es un elemento que alberga 24 electrones. Si deducimos la configuración electrónica paso a paso, sirviéndonos del diagrama, obtendríamos 1s2 2s2 2p6 3s2 3p6 4s2 3d4.
Sin embargo, la configuración electrónica real es de 1s2 2s2 2p6 3s2 3p6 4s1 3d5, o [Ar] 4s1 3d5 según la notación de Kernel. La razón es que el subnivel d es más estable estando medio lleno que conteniendo 4 electrones. Por ello, un electrón del subnivel s se desplaza hacia el subnivel d, resultando en 4s1 3d5.
Además del cromo, hay otros elementos cuya configuración no sigue el diagrama de forma estricta, como el níquel, el cobre, la plata o el cerio.
Vea también Átomo, Electrón y Orbitales atómicos.
Cómo citar: Rhoton, Stephen (29/11/2023). "Configuración electrónica". En: Significados.com. Disponible en: https://www.significados.com/configuracion-electronica/ Consultado: